Study on Properties of Quercetin-loaded Enzymatic Glycosylated Casein Composite Nanoparticles
-
摘要: 制备负载槲皮素的酪蛋白纳米粒子(n-Cas-Que)和转谷氨酰胺酶法糖基化酪蛋白纳米粒子(n-Cas-Cos-Que),探究其贮藏稳定性、体外抗消化性、生物可及度、抗氧化性及对人前列腺癌PC-3细胞的生长抑制效果。结果表明:在4 ℃避光、25 ℃避光、25 ℃自然光照条件下分别贮藏60 d,两种纳米粒子中槲皮素的保留率分别为80.78%、91.30%;66.87%、79.25%;22.18%、34.33%,即n-Cas-Cos-Que纳米粒子能够更好的保护槲皮素。体外模拟消化结果显示,n-Cas-Cos-Que比n-Cas-Que具有更好的抗消化性和更高的生物可及度。在体外模拟消化180 min后,槲皮素水溶液、n-Cas-Que和n-Cas-Cos-Que的生物可及度分别为10.13%、27.65%和48.91%。采用DPPH法和ABTS法探究两种纳米粒子的抗氧化活性,n-Cas-Cos-Que、n-Cas-Que对DPPH和ABTS的清除率分别为58.71%、53.82%和56.98%、48.34%,即n-Cas-Cos-Que比n-Cas-Que具有更好的抗氧化性。体外抑制PC-3细胞试验的结果表明,随着槲皮素浓度的增加,Que、n-Cas-Que、n-Cas-Cos-Que对PC-3细胞的抑制效果逐渐增强。当槲皮素的浓度达到80 µg/mL时,用Que、n-Cas-Que、n-Cas-Cos-Que体系处理的PC-3细胞的存活率分别为73.25%、56.84%、49.88%,且三种体系处理后的细胞存活率有显著性差异(P<0.05),说明与Que和n-Cas-Que相比,n-Cas-Cos-Que纳米粒子对PC-3细胞有更好的抑制效果。本实验结果表明了酪蛋白纳米粒子能够较好的保护槲皮素,且酶法糖基化能提高其对槲皮素的保护效果,并提高其抗消化性、生物可及度、抗氧化性和抗癌活性。Abstract: Objective: To prepare quercetin loaded casein nanoparticles (n-Cas-Que) and transglutaminase glycosylated casein nanoparticles (n-Cas-Cos-Que), and explore their storage stability, in vitro anti digestibilitiy, bioaccessibility, anti-oxidation and inhibitory effect on human prostate cancer PC-3 cells. The results showed that when stored in 4 ℃ avoid light, 25 ℃ avoid light and 25 ℃ natural light for 60 days, the retention rates of quercetin in n-Cas-Que and n-Cas-Cos-Que were 80.78%, 91.30%, 66.87%, 79.25%, 22.18%, 34.33%, respectively, which indicated that n-Cas-Cos-Que nanoparticles could protect quercetin better.The results of anti-digestion pointed out that n-Cas-Cos-Que had better anti-digestibility and higher bioavailability than n-Cas-Que. After 180 min of simulated digestion in vitro, the bioaccessibility of quercetin aqueous solution, n-Cas-Que and n-Cas-Cos-Que were 10.13%, 27.65% and 48.91%, respectively. DPPH method and ABTS method were used to investigate the antioxidant activity of the two nanoparticles. The scavenging rates of n-Cas-Cos-Que and n-Cas-Que on DPPH and ABTS were 58.71%, 53.82% and 56.98% and 48.34%, respectively, which indicated that n-Cas-Cos-Que had better antioxidant activity than n-Cas-Que. The inhibition of human prostate cancer PC-3 cells expressed that with the increase of quercetin concentration, the inhibitory effects of Que, n-Cas-Que and n-Cas-Cos-Que on PC-3 cells were gradually enhanced. When the concentration of quercetin reached 80 μg/mL, the survival rates of PC-3 cells treated with Que, n-Cas-Que and n-Cas-Cos-Que were 73.25%, 56.84% and 49.88% respectively, and there were significant differences among these survival rates (P<0.05). Compared with Que and n-Cas-Que, n-Cas-Cos-Que nanoparticles had better inhibitory effect on PC-3 cells. The results showed that casein nanoparticles can protect quercetin well, and enzymatic glycosylation can improve its protective effect on quercetin, and raise its anti digestion and biological accessibility, as well as antioxidant and anti-cancer activity.
-
Keywords:
- casein /
- chitooligosaccharide /
- transglutaminase /
- enzymatic glycosylation /
- quercetin /
- nanoparticles /
- functional materials
-
槲皮素(Quercetin,Que)是一种天然的植物类黄酮素,广泛存在于蔬菜、水果、茶叶和葡萄酒中[1-2],其具有抗氧化、改善肥胖、抗炎、抑菌等多种功效[3-6],但其难溶于水(溶解度约1 mg/L),生物利用度低,且在外界的高温、光照等条件下不稳定,易发生降解,其应用受到较大限制[7]。本科研团队在前期研究中利用转谷氨酰胺酶法糖基化修饰酪蛋白并制备糖基化复合纳米粒子,实验表明,酪蛋白、酪蛋白-壳寡糖纳米粒子能够有效包埋槲皮素并且提高其水溶性,是非常理想且具有发展前景的亲脂性药物纳米载体[8]。
与常规制剂相比,纳米粒子具有许多优点。首先,通过调整其壁材的材料与配比,可实现药物的缓释和靶向释放,并减少不良反应[9-10];其次,纳米粒子的粒径小、比表面积大且高度分散,能够提高难溶性药物的水溶性和溶出速率[11];此外,纳米粒子所形成的封闭环境,还能提升药物的生物活性和稳定性[12]。由于纳米粒子具有较小的尺寸,进入消化道以后易被微绒毛捕获并粘附到粘膜上,从而使其在体内存留时间延长,促进消化吸收;且纳米粒子的临界聚集浓度较低,在循环系统中不会因为稀释而破碎[13]。考虑到纳米粒子被人口服后,其在胃肠道系统中的稳定性高,可以使被包封的药物能更多地到达小肠等吸收部分,因此,研究负载槲皮素的酪蛋白-壳寡糖纳米粒子的稳定性及生物学性能显得尤为重要。Chen等[14]制备了负载7, 8-二羟基黄酮的玉米醇溶蛋白/乳铁蛋白纳米粒子,体外模拟消化试验表明二元纳米粒子比一元玉米醇溶蛋白纳米粒子更能够提高7, 8-二羟基黄酮的抗消化性和生物可及度。
本科研团队前期已经成功构建了负载Que的酪蛋白-壳寡糖纳米粒子并对其相关理化指标和结构特性进行了表征[8],本文将对Que纳米粒子的贮藏稳定性、体外抗消化性、生物可及度、抗氧化性以及对PC-3细胞的抑制效果进行系统探究,以期为拓展其应用打下基础。
1. 材料与方法
1.1 材料与仪器
胃蛋白酶(酶活:3000 U/g)、胰酶(酶活:3000 U/g)、槲皮素(Que,纯度:99%)、酪蛋白(Cas,纯度 > 80%) 上海阿拉丁生化科技股份有限公司;壳寡糖(分子量 < 2000 Da,脱乙酰度:90%) 浙江金壳药业有限公司;空载纳米粒子(n-Cas、n-Cas-Cos)粉末 实验室自制;酪蛋白糖基化产物(Cas-Cos) 实验室自制;雄激素非依赖性前列腺癌细胞(PC-3) 上海中科院细胞库;胎牛血清 赛默飞世尔生物有限公司;0.25%胰蛋白酶溶液(1X) 吉诺生物医药技术有限公司;噻唑蓝(MTT)、链霉素、青霉素 北京雷根生物技术有限公司;其余试剂 均为分析纯。
Zetasizer Nano ZS-90纳米粒径电位分析仪 英国Malvern公司;SLHW-4四联加热数显恒温磁力搅拌器 杭州仪表电机有限公司;PowerWaveHT微孔板分光光度计 美国BioTek公司;pHS25数显pH计 梅特勒-托利多仪器(上海)有限公司;QUINTIX65-1CN电子天平 赛多利斯有限公司;Forma 3111型二氧化碳培养箱 赛默飞世尔科技有限公司;HZ-8812S-B水浴恒温振荡器 江苏太仓华利达公司;H1850台式高速离心机 湖南湘仪仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗有限公司;SW-CJ-1FD超净工作台 苏净安泰有限公司。
1.2 实验方法
1.2.1 负载槲皮素的酪蛋白-壳寡糖和酪蛋白纳米粒子的制备
参考于钰[15]的方法,并作适当修改。分别配制浓度为4 g/L的Cas和Cas-Cos溶液,调溶液的pH为5.8。取一定量的10 g/L的Que乙醇溶液加入20 mL蛋白质溶液中,使蛋白质与Que的质量比为40:1,磁力搅拌20 min除去乙醇,将溶液在200 W的超声频率下超声处理6 min得到负载Que的纳米粒子溶液,即酪蛋白-槲皮素纳米粒子(n-Cas-Que)和酪蛋白-壳寡糖-槲皮素纳米粒子(n-Cas-Cos-Que)。
1.2.2 槲皮素纳米粒子的贮藏稳定性研究
1.2.2.1 槲皮素紫外光谱和标准曲线的绘制
配制浓度为30 μg/mL的Que乙酸乙酯溶液5 mL,取3 mL置于石英皿中,于波长300~450 nm处进行光谱扫描,得到光谱曲线,进行分析。分别配制浓度为2、4、6、8、10 μg/mL的Que乙酸乙酯溶液,测定其在369 nm处的吸光度值。以槲皮素的浓度x(μg/mL)为横坐标,吸光度值y为纵坐标绘制标准曲线。
1.2.2.2 贮藏稳定性的测定
参考闵敏[16]的方法,并作适当修改。分别取1.2.1中制得的n-Cas-Que和n-Cas-Cos-Que溶液各20 mL,将其分装至试管中,密封,分别置于4 ℃避光、25 ℃下避光、25 ℃自然光下贮藏60 d,每隔10 d取出2 mL的纳米粒子溶液,在10000 r/min下离心10 min,上清液用16 mL乙酸乙酯萃取,涡旋5 min使其充分混合,混合液8000 r/min离心5 min,分离得到乙酸乙酯相。萃取重复两次,合并萃取液。将萃取液用乙酸乙酯适当稀释,测定369 nm处的吸光值,根据1.2.2.1中的标准曲线测定纳米粒子的槲皮素含量,按下式计算保留率,以保留率表征其贮藏稳定性。采用同浓度同体积的槲皮素水溶液和乙醇溶液作为对照。
1.2.3 槲皮素纳米粒子的体外抗消化性研究
参考冯进[17]的方法并进行适当修改。
1.2.3.1 样品的制备
分别制备n-Cas-Que、n-Cas-Cos-Que溶液各20 mL(其中蛋白质的浓度为4 g/L,Que的浓度为100 µg/mL)。将2 mg的Que粉末分散于20 mL超纯水中作为对照。
1.2.3.2 胃、肠液消化实验
a.胃液消化:将胃蛋白酶、NaCl溶解于超纯水中,胃蛋白酶的浓度为3.2 g/L,NaCl的浓度为150 mmol/L。将n-Cas-Que、n-Cas-Cos-Que和Que与等量的胃液混合(各20 mL),并调pH至2.0。将混合溶液置于37 ℃摇床中,100 r/min转速下孵育60 min,孵育时间达到60 min时,将pH调至7.0以终止反应。
b.肠液消化:肠液中包含0.3 g/L的CaCl2、30.72 mmol/L NaCl、5 g/L胆汁盐以及8 g/L的胰酶。取20 mL胃液消化60 min后的溶液与等体积的肠液混合,然后将混合溶液的pH调至7.0。将混合溶液置于37 ℃摇床中,100 r/min转速下孵育120 min。
在胃-肠液的消化过程中,每隔30 min(即0、30、60、90、120、150、180 min)取出2 mL的消化液测定其粒径(DZ)、分散系数(PDI)、Zeta电位(Zeta-potential)。
1.2.4 槲皮素生物可及度的研究
参考冯进[17]的方法,并作适当修改。取10 mL1.2.3.2中消化180 min后的样品转移至离心管中,并在4 ℃,10000 r/min转速下离心60 min。样品离心后一般被分为两层,上层为负载Que的透明胶束层,下层为未消化的样品形成的致密不溶物质。分别取2 mL消化180 min后的样品和2 mL透明胶束层溶液检测Que的质量(方法参考1.2.2.2)。Que的生物可及度用以下公式计算:
式中:Wdigesta为肠液消化后样品中Que的质量;Wnanoparticles为胶束层中Que的质量。
1.2.5 槲皮素纳米粒子的抗氧化性研究
参考刘夫国[18]的方法,并作适当修改。
1.2.5.1 样品溶液的配制
制备n-Cas-Que、n-Cas-Cos-Que溶液各20 mL,分别加入到两个培养皿中,-35 ℃下冷冻12 h,然后放入真空冷冻干燥机中冻干,得n-Cas-Que和n-Cas-Cos-Que粉末。用超纯水配制蛋白质浓度为0.5 g/L的n-Cas、n-Cas-Cos、n-Cas-Que(其中Que的浓度为12.5 μg/mL)和n-Cas-Cos-Que(其中Que的浓度为12.5 μg/mL)各5 mL;分别用超纯水和无水乙醇配制浓度为12.5 μg/mL Que溶液各5 mL;用超纯水配制浓度为0.5 g/L的Cos溶液5 mL。以无样品的超纯水作为空白对照。
1.2.5.2 DPPH自由基清除实验
用无水乙醇配制1.75×10−4 mol/L的DPPH溶液,上述配制的样品溶液各取100 μL加入到2 mL DPPH乙醇溶液中,室温避光反应60 min,随后检测其在517 nm处的吸光值,每个样品重复3次测定,按下式计算自由基清除率。
1.2.5.3 ABTS自由基清除实验
取7 mmol/L的ABTS水溶液与2.45 mmol/L的过硫酸钾溶液等体积混合,避光反应12 h以上。实验前用甲醇将ABTS储备液稀释至734 nm处吸光值为0.7±0.02。上述配制的样品溶液各取100 μL加入到2 mL ABTS溶液中,振荡20 s,反应6 min,在734 nm波长处测定其吸光值,每个样品重复3次测定,按下式计算自由基清除率。
其中:A1为DPPH或ABTS空白对照的吸光值,At为反应60/6 min后样品溶液的吸光值,B为样品空白的吸光值。
1.2.6 槲皮素纳米粒子对人前列腺癌PC-3细胞抑制效果的研究
1.2.6.1 n-Cas、Cos、n-Cas-Cos样品储备液的配制
在99.5 mL的DME/F12细胞培养基中加入0.5 mL的二甲基亚砜(DMSO)溶液,成为浓度为0.5%的DMSO溶液。用此溶液配制浓度分别为400、800、1600、2400、3200 μg/mL的三种储备液(其中n-Cas和n-Cas-Cos以蛋白质浓度计),每种浓度的储备液各20 mL(细胞实验中所用的50 mL离心管经过高压灭菌锅121 ℃灭菌20 min)。
1.2.6.2 Que、n-Cas-Que、n-Cas-Cos-Que样品储备液的配制
制备n-Cas-Que、n-Cas-Cos-Que溶液各20 mL,分别加入到两个培养皿中,−35 ℃下冷冻12 h,然后放入真空冷冻干燥机中冻干,得n-Cas-Que和n-Cas-Cos-Que粉末。在99.5 mL的DME/F12细胞培养基中加入0.5 mL的DMSO溶液,成为浓度为0.5%的DMSO溶液。利用此溶液配制槲皮素浓度分别为10、20、40、60、80 μg/mL的三种储备液(其中负载槲皮素的蛋白质浓度与n-Cas、n-Cas-Cos储备液的蛋白质浓度相同,均为400~3200 μg/mL)。
1.2.6.3 不同样品对人前列腺癌PC-3细胞抑制效果的影响
参考赵波[19]的方法,并作适当改动。取对数生长期的PC-3细胞,加入0.25%胰蛋白酶消化液150 μL,调整细胞密度为5×104个/mL,以每孔200 μL细胞悬液接种于96孔板中,最边缘孔用PBS代替,待上述96孔板中的细胞培养24 h后,弃去原培养基,加入200 μL不同浓度的样品储备液,每组设置6个复孔,培养24 h,以不含样品,含0.5% DMSO的培养基为空白对照。在测定前4 h加入含有10% MTT溶液的培养基,置于培养箱中继续孵育4 h,弃去上清液,每孔加入150 μL的DMSO,置于摇床上振荡10 min,最后置于570 nm处测定吸光值,计算细胞存活率。
式中: A2为实验组吸光值,A1为空白对照组吸光值,AZ为空白孔的吸光值。
1.3 数据处理
实验所得数据使用Origin 2018绘制相关图表,使用SPSS 20.0软件对数据进行单因素方差分析(ANOVA)。每次测试前需更换样品,且每组实验均重复3次,实验结果用平均值±标准差(Mean±SD)。
2. 结果与分析
2.1 槲皮素纳米粒子的贮藏稳定性分析
本实验研究了不同条件下游离的Que水溶液、乙醇溶液以及负载Que的两种纳米粒子的贮藏稳定性。四种Que溶液体系的保留率如图 1所示。
Que的紫外光谱曲线如图 1a所示,槲皮素在369 nm处的紫外吸光度值最高。因此,选取369 nm作为Que乙酸乙酯溶液的最大吸收波长。槲皮素的标准曲线如图 1b所示,标准曲线线性拟合效果良好。
图 1A中,4种体系在4 ℃下避光贮存60 d后,n-Cas-Cos-Que中Que的保留率为91.30%;而图 1B显示,在25 ℃下避光贮存60 d后,n-Cas-Cos-Que中Que的保留率为79.25%。游丽君等[20]利用热诱导法制备酪蛋白-槲皮素纳米粒子,在4 ℃避光条件下贮藏30 d后,Que的保留率为75.38%。表明酶法糖基化能提高酪蛋白对Que的保护效果。图 1C中,在自然光照下贮存60 d后,Que的水溶液、乙醇溶液两种体系中Que的保留率几乎为0,而n-Cas-Que和n-Cas-Cos-Que的保留率分别为22.18%和34.33%。这表明了纳米载体能够减缓Que的降解,且n-Cas-Cos-Que的双层结构对Que有更好的保护效果。
结合图 1A和B可得出,贮存温度升高后,n-Cas-Cos-Que中Que的保留率有所下降,而其它3种溶液体系也表现出相似的降低趋势。这表明贮存温度的升高会减弱纳米粒子对Que的保护效果。此外,在两种条件下,n-Cas-Cos-Que中Que的保留率均高于其它3种体系,这表明n-Cas-Cos-Que能够更加有效地保护Que,减少外界条件对Que的损害。
结合图 1B和C,可以看出在光照条件下n-Cas-Cos-Que中Que的保留率明显下降,从79.25%下降至34.33%,其它3种体系也表现出相似的降低趋势。这表明光照会加速Que的降解。
2.2 槲皮素纳米粒子的体外抗消化性分析
在体外模拟胃肠道消化中,两种Que纳米粒子的DZ、Zeta-potential和PDI如图 2所示。
在0~60 min模拟胃液阶段,n-Cas-Que的DZ呈现出迅速增大的趋势,从169.1 nm迅速增加到2854.2 nm(图 2A);Zeta-potential从14.5 mV降低到8.95 mV(图 2B);PDI从0.217增加到0.859(图 2C);此时纳米粒子溶液中出现了絮状沉淀。其原因可能是n-Cas-Que经过胃液水解后,胃液中的盐离子屏蔽了蛋白质表面电荷,使蛋白质表面电荷量降低,分子间静电斥力降低,易导致蛋白质发生聚集。同时,胃液中胃蛋白酶会促使蛋白质之间的发生架桥絮凝或排斥絮凝[21-23]。溶液的PDI迅速增大,表明溶液中纳米颗粒分布不均一。而对于n-Cas-Cos-Que,其粒径从0 min时的125.6 nm增加到60 min时的1073 nm(图 2A);Zeta-potential从14.96 mV降低到10.06 mV(图 2B);PDI从0.161增加到0.804(图 2C);纳米粒子溶液中未出现明显絮状沉淀。这表明,n-Cas-Cos-Que纳米粒子经过胃液消化之后,同样出现DZ增加、Zeta-potential降低等现象,但n-Cas-Cos-Que纳米粒子在胃液消化过程中的粒径增加幅度要远小于n-Cas-Que纳米粒子。其原因可能是Cas经过糖基化后,其二级结构变得更加有序,不容易被胃蛋白酶水解[24],蛋白质在经过胃蛋白酶消化过程中,首先会消化Cos外壳,这延缓了蛋白质被消化聚集。以上结果表明n-Cas-Cos-Que在胃液中有较好的抗消化效果。
在60~180 min之间,n-Cas-Que和n-Cas-Cos-Que进入肠液消化阶段。对于n-Cas-Que,其DZ从2854.2 nm减小到423.6 nm(图 2A);Zeta-potential从8.95 mV变化到−13.76 mV(图 2B);PDI从0.859减小到0.436(图 2C);纳米粒子溶液无絮状沉淀。这表明n-Cas-Que经过肠液消化之后,其在胃液中形成的聚集体发生解离,使溶液的粒径减小。Zeta-potential从正值变到负值,且电位的绝对值增大,这是因为肠液的pH高于蛋白质的等电点。蛋白质在高于其等电点的溶液中带负电。另外,pH和肠液中的离子强度增强了蛋白质的电荷量,使其分子间静电排斥增强,从而提高了稳定性[25]。对于n-Cas-Cos-Que,其DZ在肠液中呈现出先增大后减小的趋势,从1073 nm增加到2919 nm再减小到392.7 nm(图 2A);Zeta-potential从10.06 mV变化到−16.93 mV(图 2B);PDI从0.804减小到0.431(图 2C);无明显絮状沉淀产生。这表明Cas-Cos在胰酶的作用下继续被消化而发生聚集,使其粒径变大,在一段时间的肠液继续消化后,n-Cas-Cos-Que粒径呈现出降低的趋势,这表明聚集体发生解离。另外由于肠液中存在着CaCl2、NaCl等盐,其中的离子会对蛋白质电荷起到一定屏蔽的作用。但总的来看,肠液消化后,蛋白质所带的电荷量要高于胃液消化后所带的电荷量。肠液消化后两种纳米粒子的粒径电荷量相似,这可能是纳米颗粒经过肠液消化后,溶液中的组成相似,包括少量的未消化样品、混合胶束、胆汁盐和析出的Que、钙皂等[26]。
2.3 槲皮素纳米粒子的生物可及度分析
通过体外模拟消化对Que、n-Cas-Que、n-Cas-Cos-Que的生物可及度进行评价。生物可及度是指消化后,活性物质从食物基质中释放并溶解在消化液中,可以被小肠吸收的部分占其在消化液中总量的比例[21]。不同样品的生物可及度如表 1所示。
如表 1所示,游离的槲皮素分散在水中处于结晶状态,其溶解度较低,经过胃肠道消化后,其生物可及度为10.13%。这种结果的原因可能是肠液中存在的胆汁盐,使Que转移至混合胶束中,提高了Que的溶解度。但是,Que经过纳米粒子包埋后,其水溶性增加,使n-Cas-Que和n-Cas-Cos-Que的生物可及度可分别达到27.65%、48.91%,与Que相比,分别增加了1.72倍和3.83倍。同时,Cas和Cas-Cos在经过胃蛋白酶和胰酶水解后,产生部分肽类,这些肽类可以与游离的Que相结合,进一步提高其在水中的溶解度,从而增加其生物可及度。另外,n-Cas-Cos-Que的生物可及度显著高于n-Cas-Que(P < 0.05),其原因可能一方面是糖基化作用使得复合纳米粒子在消化系统中更加稳定,纳米粒子的非晶体态促进结晶Que在胶束化过程中的溶解度[27];另一方面,在胃肠道酶的水解过程中,糖基化接入的Cos也能够结合游离的Que,从而提高其溶解度[21]。Francisco等[28]利用玉米醇溶蛋白纳米粒子包埋Que,使Que的体外生物可及度提升了1.6倍。综上,n-Cas-Que能显著提高Que的生物可及度,且n-Cas-Cos-Que的提升效果要优于n-Cas-Que。
2.4 槲皮素纳米粒子的抗氧化性能分析
Que具有抗氧化性,其抗氧化作用取决于其酚羟基,其中Que A环上的5-OH和7-OH及B环上的3'-OH和4'-OH是主要的抗氧化基团。有前人研究表明,多酚类物质与蛋白质结合后,其抗氧化活性降低[29]。本研究采用DPPH和ABTS法来评价不同溶液体系的抗氧化性。
如表 2所示,在本实验条件下,Cos、n-Cas和n-Cas-Cos对DPPH的清除率分别为56.8%、6.27%、11.98%,这表明Cas经过糖基化后,其抗氧化性提高,其原因可能Cos共价接入Cas后,产生协同作用,使Cas-Cos的抗氧化性增强。如表 3所示,槲皮素水溶液、槲皮素醇溶液(Que-乙醇)、n-Cas-Que和n-Cas-Cos-Que对DPPH的清除率分别为18.83%、65.26%、53.82%、58.71%,ABTS自由基活性清除结果与DPPH清除结果有着相似的趋势。从这样的结果可以看出,Que水溶液对DPPH的清除效果较差,其原因可能是槲皮素在水溶液中溶解度低,处于结晶态,不能与自由基进行有效接触,所以其抗氧化性远小于Que乙醇溶液。而Que经过Cas和Cas-Cos包埋之后,其水溶性增加,抗氧化性也大大提升,但低于溶解在无水乙醇中的Que溶液,其原因可能是Que中的活性基团与蛋白质分子间的形成氢键,对活性基团产生一定的屏蔽效果[30]。
表 2 3种原材料的DPPH和ABTS自由基清除能力Table 2. DPPH and ABTS free radical scavenging ability of the three raw materials样品 DPPH清除率(%) ABTS清除率(%) Cos 56.8±0.67a 54.24±0.78a n-Cas 6.27±0.88c 4.33±0.65c n-Cas-Cos 11.98±1.4b 10.21±0.9b 表 3 不同纳米粒子的DPPH和ABTS自由基清除能力Table 3. DPPH and ABTS free radical scavenging ability of different nanoparticles样品 DPPH清除率(%) ABTS清除率(%) Que-水 18.83±1.1d 15.71±0.65d Que-乙醇 65.26±1.7a 61.52±1.6a n-Cas-Que 53.82±0.72c 48.34±1.3c n-Cas-Cos-Que 58.71±1.5b 56.98±1.9b 2.5 槲皮素纳米粒子对人前列腺癌PC-3细胞抑制效果的研究
很多研究报道,Que具有很多生物学功效,其中最重要的是抗癌活性。槲皮素能够抑制多种癌细胞,包括肺癌细胞、胰腺癌细胞、乳腺癌细胞的增殖,并表现出诱导其凋亡的作用[31-33]。为了考察槲皮素纳米粒子的抗癌活性,本研究采用经典的MTT法、以细胞存活率来评价纳米粒子对PC-3细胞的抑制效果。
图 3A研究了不同浓度的n-Cas、Cos、n-Cas-Cos溶液对PC-3细胞的抑制效果。由图可知,随着浓度的升高,三种样品对PC-3细胞的生长有一定的促进作用。其原因可能是Cas和Cos为PC-3细胞的增殖提供了必要的营养物质[34]。
图 3B研究了不同浓度的Que溶液对PC-3细胞的抑制效果。从图中可以看出,随着Que浓度的增加,Que、n-Cas-Que、n-Cas-Cos-Que对PC-3细胞的抑制效果逐渐增强。当Que的浓度达到80 μg/mL,三种Que体系处理PC-3细胞后的存活率分别为73.25%、56.84%、49.88%(P < 0.05)。这表明Que经过Cas、Cas-Cos包埋之后,能提高其对PC-3细胞的抑制效果。其原因可能是纳米粒子提高了Que的水溶性,改善其所处的微环境,使其有更多的有效活性基团与PC-3细胞接触。这一结果也与前人的研究结论相符[29]。另外,n-Cas-Cos-Que对Que有更高的包埋率,能够包埋更多的Que,使更多的Que活性基团与PC-3接触,这也可能是n-Cas-Cos-Que对PC-3抑制效果更好的原因。
3. 结论
本文主要探究了n-Cas-Que和n-Cas-Cos-Que两种纳米粒子的贮藏稳定性、体外抗消化性、生物可及度、抗氧化性及对PC-3细胞的抑制效果。两种纳米粒子均表现出较好的贮藏稳定性。在4 ℃避光和25 ℃避光和25 ℃自然光照射条件下分别贮藏60 d,两种纳米粒子的保留率分别为80.78%、91.30%;66.87%、79.25%;22.18%、34.33%。这表明与Que水溶液和醇溶液相比,n-Cas-Que和n-Cas-Cos-Que能够对Que起到很好的保护效果,且n-Cas-Cos-Que的保护效果更好。体外模拟胃肠道消化结果表明,n-Cas-Cos-Que比n-Cas-Que具有更好的抗消化性和更高的生物可及度。在体外模拟消化180 min后,Que水溶液以及n-Cas-Que和n-Cas-Cos-Que两种纳米粒子的生物可及度分别为10.13%、27.65%和48.91%。DPPH和ABTS的清除实验显示Que经过Cas和Cas-Cos包埋后,其抗氧化能力大大提升,n-Cas-Cos-Que、n-Cas-Que对DPPH和ABTS的清除率分别为58.71%、53.82%和56.98%、48.34%。体外抑制PC-3细胞试验的结果表明,n-Cas-Que、n-Cas-Cos-Que两种纳米粒子对PC-3细胞的抑制作用具有浓度依赖性,且与Que和n-Cas-Que相比,n-Cas-Cos-Que纳米粒子对PC-3细胞有更好的抑制效果。
本实验证实负载槲皮素的酶法糖基化酪蛋白纳米粒子(n-Cas-Cos-Que)能够有效保护Que,降低外部条件对Que的损害并减缓Que的降解,提高其生物可及度、抗氧化性和抗癌活性,进一步拓宽了其在医药及功能性食品领域的应用。在今后的研究中,可探究n-Cas-Cos-Que在细胞水平上的生物学性能,并利用不同方法的糖基化(如美拉德反应糖基化)与本文方法作对比,比较不同方法的糖基化酪蛋白纳米粒子对槲皮素的保护效果,并探究其性能,以期将槲皮素应用到更广泛的领域。
-
表 1 不同样品的生物可及度
Table 1 Bioaccessibility of different samples
表 2 3种原材料的DPPH和ABTS自由基清除能力
Table 2 DPPH and ABTS free radical scavenging ability of the three raw materials
样品 DPPH清除率(%) ABTS清除率(%) Cos 56.8±0.67a 54.24±0.78a n-Cas 6.27±0.88c 4.33±0.65c n-Cas-Cos 11.98±1.4b 10.21±0.9b 表 3 不同纳米粒子的DPPH和ABTS自由基清除能力
Table 3 DPPH and ABTS free radical scavenging ability of different nanoparticles
样品 DPPH清除率(%) ABTS清除率(%) Que-水 18.83±1.1d 15.71±0.65d Que-乙醇 65.26±1.7a 61.52±1.6a n-Cas-Que 53.82±0.72c 48.34±1.3c n-Cas-Cos-Que 58.71±1.5b 56.98±1.9b -
[1] Alinezhad H, Azimi R, Zare M, et al. Antioxidant and antihemolytic activities of ethanolic extract of flowers, leaves, and stems of Hyssopus officinalis L. var. angustifolius[J]. International Journal of Food Properties,2013,16(4-5-6):1169−1178.
[2] Arias N, Macarulla M T, Aguirre L, et al. Quercetin can reduce insulin resistance without decreasing adipose tissue and skeletal muscle fat accumulation[J]. Genes & Nutrition,2014,9(1):361.
[3] 郭艳芳, 张皓, 朱玲, 等. 槲皮素改善糖尿病肥胖大鼠糖脂代谢紊乱及总胆固醇的作用[J]. 解剖学研究,2018,40(6):505−509. doi: 10.3969/j.issn.1671-0770.2018.06.012 [4] Nabavi S F, Russo G L, Daglia M, et al. Role of quercetin as an alternative for obesity treatment: You are what you eat[J]. Food Chemistry,2015(7):305−310.
[5] Yuan K, Zhu Q Q, Lu Q Y, et al. Quercetin alleviates rheumatoid arthritis by inhibiting neutrophil inflammatory activities[J]. The Journal of Nutritional Biochemistry,2020:108454.
[6] 洪志伟, 孟令宇, 葛雅琨, 等. 槲皮素对大肠杆菌和金黄色葡萄球菌的体外抑菌作用的研究[J]. 吉林化工学院学报,2017,34(5):38−41. [7] Cai X, Fang Z, Dou J, et al. Bioavailability of quercetin: Problems and promises[J]. Current Medicinal Chemistry,2013(20):2572−2582.
[8] 樊永康, 刘健华, 刘尧, 等. 负载槲皮素的酶法糖基化酪蛋白复合纳米粒子的构建与表征[J]. 食品工业科技, 2021, 42(8): 49−57. [9] Pelaz B, Alexiou C, Alvarez Puebla R, et al. Diverse applications of nanomedicine[J]. Acs Nano,2017,11(3):2313−2381. doi: 10.1021/acsnano.6b06040
[10] Park J, Park J, Pei Y H, et al. Pharmacokinetics and biodistribution of recently-developed siRNA nanomedicines[J]. Advanced Drug Delivery Reviews,2015,104:93−109.
[11] 张文君, 吴梦婷, 张国锋, 等. 白藜芦醇纳米传递系统的研究进展[J/OL]. 食品科学: 1-11[2021-01-10]. http://kns.cnki.net/kcms/detail/11.2206.TS.20201212.0811.004.html. [12] 姜伟明, 郭圣荣. 载体材料在改善纳米粒肠道吸收研究中的应用[J]. 南京中医药大学学报,2013(3):297−300. doi: 10.3969/j.issn.1000-5005.2013.03.027 [13] Anselmo A C, Mitragotri S. Nanoparticles in the clinic[J]. Bioengineering & Translational Medicine,2016,1(1):10−29.
[14] Chen Y F, Zhao Z L, Guo X B, et al. Fabrication and characterization of zein/lactoferrin composite nanoparticles for encapsulating 7, 8-dihydroxyflavone: Enhancement of stability, water solubility and bioaccessibility[J]. International Journal of Biological Macromolecules,2020,146:179−192. doi: 10.1016/j.ijbiomac.2019.12.251
[15] 于钰. 酪蛋白自组装纳米粒的超声制备及其应用[D]. 青岛: 中国海洋大学, 2012. [16] 闵敏. 糖基化酪蛋白的制备、及其性能和应用研究[D]. 杭州: 浙江工商大学, 2017. [17] 冯进. 基于葡萄糖双子表面活性剂和卵白蛋白的生物活性物质载体制备和特性研究[D]. 杭州: 浙江大学, 2017. [18] 刘夫国. 蛋白质-多酚-碳水化合物共价复合物制备及其对功能因子稳态作用[D]. 北京: 中国农业大学, 2017. [19] 赵波. 沙棘黄酮提取及体外抑制人前列腺癌PC-3细胞作用研究[D]. 杭州: 浙江大学, 2018. [20] 游丽君, 刘敏, 林恋竹, 等. 载荷槲皮素的酪蛋白纳米粒子输送载体的构建[J]. 华南理工大学学报( 自然科学版),2017(45):139−145. [21] Feng J, Lin C, Wang H, et a1. Decoration of gemini alkyl O-glucosides based vesicles by electrostatic deposition of sodium carboxymethyl cellullose: Mechanism, structure and improved stability[J]. Food Hydrocolloid,2016,58:284−297. doi: 10.1016/j.foodhyd.2016.03.012
[22] Zou L, Zheng B, Zhang R, et al. Food-grade nanoparticles for encapsulation, protection and delivery of curcumin: Comparison of lipid, protein, and phospholipid nanoparticles under simulated gastrointestinal conditions[J]. Rsc Advances,2016,6:3126−3136. doi: 10.1039/C5RA22834D
[23] Geno X, Cui B, Li Y, et al. Preparation and characterization of ovalbumin and carboxymethyl cellulose conjugates via glycosylation[J]. Food Hydrocolloids,2014,37:86−92. doi: 10.1016/j.foodhyd.2013.10.027
[24] Horne D S. Casein structure, self-assembly and gelation[J]. Current opinion in colloid & interface science,2002,7(5-6):456−461.
[25] Salvia T L, Qian C, Martin B O, et al. Influence of particle size on lipid digestion and beta-carotene bio-accessibility in emulsions and nano emulsions[J]. Food Chemistry,2013,141:1472−1480. doi: 10.1016/j.foodchem.2013.03.050
[26] Sarkar A, Horne D S, Singh H. Interactions of milk protein-stabilized oil-in-water emulsions with bile salts in a simulated upper intestinal model[J]. Food Hydrocolloids,2010,24:142−51. doi: 10.1016/j.foodhyd.2009.08.012
[27] Muhoza B, Zhang Y, Xia S, et al. Improved stability and controlled release of lutein-loaded micelles based on glycosylated casein via Maillard reaction[J]. Journal of Functional Foods,2018,45:1−9. doi: 10.1016/j.jff.2018.03.035
[28] Francisco R, Carmen L D, Cinco-Moroyoqui F J, et al. Preparation and characterization of quercetin-loaded zein nanoparticles by electrospraying and study of in vitro bioavailability[J]. Journal of Food Science,2019,84(2):2883−2897.
[29] Khan M K, Rakotomanomana N, Dufour C, et al. Binding of citrus flavanones and their glucuronides and chalcones to human serum albumin[J]. Food & Function,2011,2(10):617−626.
[30] Gogary E, Riham I, Rubio, et al. Polyethylene glycol conjugated polymeric nanocapsules for targeted delivery of quercetin to folate-expressing cancer cells in vitro and in vivo[J]. ACS Nano,2014,8(2):1384−1401. doi: 10.1021/nn405155b
[31] Moon J H, Eo S K, Lee J H. Quercetin-induced autophagy flux enhances TRAIL-mediated tumor cell death[J]. Oncology Reports,2015,34(1):375−380. doi: 10.3892/or.2015.3991
[32] Angst E, Park J L, Moro A, et al. The flavonoid quercetin inhibits pancreatic cancer growth in vitro and in vivo[J]. Pancreas,2013,42(2):223−229. doi: 10.1097/MPA.0b013e318264ccae
[33] Schroeder L, Marahrens P, Koch J G, et al. Effects of green tea, matcha tea and their components epigallocatechin gallate and quercetin on MCF -7 and MDA-MB-231 breast carcinoma cells[J]. Oncology Reports,2019,41(1):387−396.
[34] 郝建鹏. 槲皮素纳米微胶囊的制备及性能研究[D]. 杨凌: 西北农林科技大学, 2016.






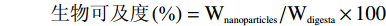
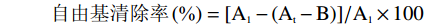
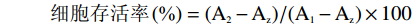

 下载:
下载:


 下载:
下载:
