Comparative of Surface Layer Proteins Extraction Methods for Lactobacillus
-
摘要: 本文通过电泳比较了5 mol/L LiCl法、4 mol/L盐酸胍法、8 mol/L尿素法和5 mol/L LiCl结合1 mol/L LiCl法提取嗜酸乳杆菌JCM 1132表层粗蛋白方法,并进一步研究了不同提取方法对乳杆菌表面特性的影响。结果表明:两种不同浓度的LiCl法是提取表层蛋白的最适方法,该方法提取可得到纯度较高的表层蛋白。且用该方法剥离表层蛋白后,菌体的存活率最高,约为99.27%。不同方法去除表层蛋白后,菌体的表面电荷、表面疏水性、自聚集能力以及与沙门氏菌的共聚集能力均有所降低。表明表层蛋白对嗜酸乳杆菌表面性质起关键性作用,对乳杆菌益生功能的积极影响。Abstract: In this paper, SDS-PAGE had determined the best dissociating agent for extracting surface layer proteins from Lactobacillus acidophilus JCM 1132 in the 5 mol/L LiCl, 4 mol/L guanidine hydrochloride, 8 mol/L urea, 5 mol/L LiCl combined with 1 mol/L LiCl. The effect of different treatment methods on the surface characteristics of Lactobacillus was further studied. The results shoeed that two different concentrations of LiCl was the chosen as the best dissociating agent for extracting surface layer proteins, and this method could extract high purity surface layer proteins. And after using this method to remove the surface layer proteins, the survival rate of the L. acidophilus was the highest, about 99.27%. The surface charge, surface hydrophobicity, self-aggregation and co-aggregation with Salmonella were all reduced after the removal of the surface layer proteins by different methods. It showed that surface layer proteins played a key role in the surface properties of L. acidophilus and positively influence the probiotic function of the bacterium.
-
Keywords:
- Lactobacillus /
- surface layer proteins /
- extraction method /
- probiotic properties
-
乳杆菌作为益生菌的一大类,可黏附定植于肠道细菌,均衡肠道内微生物,影响免疫调节功能,减少病原菌在胃肠道的定殖[1-2]。乳杆菌对肠道上皮细胞的黏附作用与菌体表面的疏水作用、静电作用和菌体本身的聚集能力相关。这些都与乳杆菌的表面成分相关,其中表层蛋白起着至关重要的作用[3-6]。多数乳杆菌的外表都覆盖着一层表层蛋白,可经自组装形成对称次晶格阵列结构,在乳杆菌的总蛋白含量中占比较大[7-9]。表层蛋白的提取通常采用高浓度解离剂法,表层蛋白亚基以及表层蛋白与细胞壁之间通过非共价键连接,因此可通过高浓度的解离剂提取表层蛋白[10]。LiCl(氯化锂)、盐酸胍和尿素是常用的表层蛋白解离剂[11-13]。尹琼芳等[14]分别利用4 mol/L 盐酸胍和5 mol/L LiCl提取L. acidophilus CGMCC 1.1878和L. acidophilus LA1的表层蛋白,电泳发现其分子量约为46 kDa。结果发现5 mol/L LiCl提取的粗蛋白含量更多,效果更好。Zhang等[15]分别利用LiCl和尿素提取L. acidophilus CICC6074 表层蛋白,分子量约为46 kDa。目前关于表层蛋白的提取方法差异性较大,通常采用高浓度的解离剂提取方法。但高浓度解离剂提取的表层蛋白通常含有杂蛋白,因此需进一步优化蛋白的提取方法。
本文用5 mol/L LiCl法、4 mol/L盐酸胍法、8 mol/L尿素法、两种不同浓度的LiCl法(5 mol/L和1 mol/L)提取乳杆菌表层蛋白,通过比较每种方法所提取蛋白的总蛋白浓度、对乳杆菌的表面特性以及存活率的影响,找到提取乳杆菌表层蛋白的最适方法。为之后研究乳杆菌表层蛋白的结构性质与功能应用奠定基础。
1. 材料与方法
1.1 材料与仪器
嗜酸乳杆菌(L. acidophilus)JCM 1132 由中国普通微生物菌种保藏管理中心提供;电泳低分子量标准蛋白(Marker,相对分子质量范围 14.4~97.4 kDa)、透析袋(截留分子量8~14 kDa) 上海源叶生物科技有限公司;其它试剂 均为分析纯。
ZD85气浴恒温振荡器 国华电器有限公司;GL-20G高速冷冻离心机 上海安亭科学仪器厂;722S型分光光度计 上海渡杨精密仪器;GNP-9050电热恒温鼓风干燥箱 上海精宏仪器厂;SW-CJ-2F型双人双面净化工作台 上海笃特科学仪器厂;MVS1漩涡混合机 北京金北德工贸有限公司;ML204电子天平 梅特勒托利多仪器有限公司。
1.2 实验方法
1.2.1 菌种的活化与传代
在安瓿瓶管内加入无菌的MRS(de Man-Rogosa-Sharpe)液体培养基,轻轻振荡。取适量菌悬液转接到MRS固体培养基,37 oC恒温培养48 h。接种环挑取单菌落接种于MRS液体培养基,37 oC恒温培养18 h。取培养液再次转接MRS液体培养基中,按接种量2%(v/v),37 oC恒温摇床培养18 h,以此提高菌株活性,置于4 ℃冰箱内用于实验备用。
1.2.2 表层蛋白的提取
1000 mL的乳杆菌菌悬液离心(5000 r/min,15 min),收集菌体。无菌PBS(pH 7.2)洗涤两次,再次离心收集菌体。分别加入菌悬液1/20体积的提取剂(5 mol/L LiCl,4 mol/L盐酸胍,8 mol/L尿素)重悬菌体,37 oC处理30 min。4 oC下12000 r/min离心20 min,所得上清液即为表层蛋白粗提液。在4 oC下用去离子水对上清液进行透析48 h,12000 r/min离心20 min收集沉淀,即为不同提取方法提取的表层蛋白[16]。
将按上述方法5 mol/L LiCl提取的沉淀再加入菌悬液1/20体积的1 mol/L LiCl溶液重悬,37 oC处理30 min。4 oC下12000 r/min离心20 min,所得上清液即为两种不同浓度的LiCl(5 mol/L和1 mol/L)提取两次所得到的表层蛋白粗提液。去离子水透析,离心收集沉淀。
1.2.3 表层蛋白浓度的测定
实验采用NanoDrop 2000C 超微量分光光度计测定样品溶液分别在260 nm和280 nm处的OD值,蛋白质浓度计算公式为:
C(mg/mL)=1.45×OD280−0.74×OD260 1.2.4 表层蛋白相对分子质量的测定
配制5%浓缩胶和12%分离胶进行SDS-PAGE(聚丙烯酰胺凝胶电泳)。将表层蛋白样品溶于10%的SDS溶液中,2×上样缓冲液与样品等体积混合,沸水浴加热5 min,上样量15 μL。浓缩胶电压80 V,分离胶电压120 V。
1.2.5 乳杆菌存活率的测定
37 oC恒温摇床培养乳杆菌18 h,离心收集菌体(5000 r/min,4 oC,5 min)。600 nm波长下调整菌悬液吸光值至(1.00±0.01),离心收集菌体。无菌PBS等比稀释菌体后,将菌体涂布于MRS固体培养基,活菌计数,三组平行实验取其平均值,记为N0。分别取5 mol/L LiCl、4 mol/L盐酸胍、两种不同浓度的LiCl法(5 mol/L和1 mol/L)、8 mol/L尿素处理后的菌体,实验操作如上所述。对失去表层蛋白的乳杆菌进行菌落计数,记为N1。依照公式计算乳杆菌的存活率:
存活率(%)=N1N0×100 1.2.6 乳杆菌表面疏水性的测定
参考Kos等[17]的MATH方法,分别计算不同方法处理后菌体的表面疏水率。0.01 mol/L无菌PBS洗涤菌体两次后,菌体重悬于0.1 mol/L KNO3溶液(pH6.2)。600 nm波长下调节菌悬液的OD值为(0.50±0.01),准确读数,记为A0。0.1 mol/L KNO3 溶液作为空白对照组,将菌悬液与二甲苯按照3:1的体积比混合,室温反应10 min,漩涡振荡2 min后,再次室温反应20 min。测定分层后的水相在波长600 nm处的OD值,记为A1。乳杆菌表面疏水率的计算如下:
疏水率(%)=(1−A1A0)×100 1.2.7 乳杆菌表面电荷的测定
参考Kos等[17]的实验方法,路易斯酸碱采用三氯甲烷和乙酸乙酯,测定表层蛋白与菌体表面电荷的关系。离心得到的菌体重悬于0.1 mol/L KNO3溶液(pH6.2)。600 nm波长下调节菌悬液的OD值为0.50±0.01,准确读数,记为A0。0.1 mol/L KNO3 溶液作为空白对照组,将菌悬液与三氯甲烷或乙酸乙酯按照3:1的体积比混合,室温反应10 min,漩涡振荡2 min后,再次室温反应20 min。测定分层后水相的OD600值,记为A1。不同方法提取表层蛋白后乳杆菌溶剂吸附率的计算如下:
溶剂吸附率(%)=(1−A1A0)×100 1.2.8 乳杆菌自动聚集能力的测定
参考刘珊娜等[18]的实验方法,菌悬液5000 r/min离心15 min得到菌体,PBS洗涤两次后重悬于PBS缓冲液中。600 nm波长下调节菌悬液的OD值为(0.50±0.01),准确读数,记为A0。将菌悬液混匀,室温静置4 h,测定分层后水相的OD600值,记为A4。乳杆菌自动聚集率的计算公式如下:
自动聚集率(%)=(1−A4A0)×100 1.2.9 乳杆菌与致病菌的共聚集能力的测定
37 oC恒温摇床培养乳杆菌18 h,菌悬液(5000 r/min,4 oC,5 min)离心得到的菌体重悬于0.1 mol/L KNO3溶液(pH6.2)。600 nm波长下调节菌悬液的OD值为0.50±0.01。将2 mL乳杆菌菌悬液与致病菌菌悬液等量混合,旋涡振荡10 s。室温下放置4 h后测定OD600值,记为AM。同时分别取4 mL乳杆菌和致病菌悬液作为对照组,室温下放置4 h后OD600值,分别记为AL和AP[19]。依照如下公式计算不同提取方法后失去表层蛋白的乳杆菌与致病菌的共聚集率:
共聚集率(%)=(1−2AMAP+AL)×100 1.3 数据分析
实验所得数据为三次平行实验的平均值,通过 SPSS Statistics 20.0®(美国 IBM 公司)对数据进行单因素方差分析,当P<0.05时,代表数据的差异性显著。
2. 结果与讨论
2.1 表层蛋白的SDS-PAGE分析
表层蛋白与细胞壁之间通过非共价键相连接,高浓度的解离剂如LiCl、盐酸胍和尿素等可以提取表层蛋白。Johnson等[20]提出,先用5mol/L LiCl处理后再用1 mol/L LiCl处理提取表层蛋白可得到纯度较高的表层蛋白。本实验采用四种不同方法提取表层蛋白,对蛋白样品进行SDS-PAGE分析,比较各方法提取的表层蛋白的纯度,结果如图1。
已知嗜酸乳杆菌表层蛋白的分子量约为46 kDa[21-23],图中可以看出2和3号泳道蛋白条带最为密集,粗蛋白分子量分布较广,但目标蛋白(46 kDa)的提取量低。推测可能是盐酸胍和尿素导致表层蛋白的降解。泳道1和4提取的目标蛋白的量明显增加,在46 kDa左右有明显的蛋白条带,与之前的研究结果相符[15]。泳道4有明显的单一的蛋白条带,提取效果最好,故5 mol/L和1 mol/L LiCl法是最适提取表层蛋白的方法。
2.2 蛋白含量测定
不同方法提取的表层蛋白浓度结果如图2。两种不同浓度LiCl法所得表层蛋白浓度是最高的,为4.61 mg/mL,5 mol/L LiCl法次之,8 mol/L尿素法浓度最低。说明用两种不同浓度LiCl法提取表层蛋白,可以更彻底地将表层蛋白粗提液中的糖类、脂类等其他大分子过滤掉,从而提取得更高纯度的蛋白样品。
2.3 不同提取方法对乳杆菌存活率影响
在实验过程中,表层蛋白的提取剂对乳杆菌菌体的损伤是不可避免的,但不同提取剂对菌体的损伤是否会引起其存活率的大幅度下降尚未可知。
本实验采用平板计数法研究了不同提取方法对乳杆菌存活率的影响,结果如表1所示。用两种不同浓度LiCl(5 mol/L和1 mol/L)处理后,乳杆菌存活率最高,其他方法处理的菌体存活率损失在14%~17%左右,均在一个1个log以内,说明表层蛋白的去除对乳杆菌的存活没有太大影响。研究发现LiCl处理L. helveticus ATCC 12046后引起了菌体1个log内的损伤[24]。孟珺等[25]也发现LiCl剥离乳杆菌表层蛋白后引起的菌体损伤在6%~11%左右,均在一个1个log以内,与本实验结果与其一致。
2.4 不同提取方法对乳杆菌表面疏水性的影响
乳杆菌可通过特异性黏附和非特异性黏附定植于上皮细胞,其中疏水作用力是乳杆菌非特异性黏附的重要作用力。Perez等[26]发现黏附性较好的双歧杆菌菌株都具备高疏水性。为了研究表层蛋白提取方法对乳杆菌表面疏水性的影响,本实验选择四种不同的蛋白提取方法测定乳杆菌表面疏水性的变化。
结果如表2所示,未处理的L. acidophilus JCM 1132的表面疏水率为47.00%,四种方法处理后的L. acidophilus JCM 1132表面疏水率均有显著下降(P<0.05)。其中,用5 mol/L LiCl处理后的菌株和5 mol/L和1 mol/L LiCl处理后的菌株表面疏水率最低,约为13.87%。5 mol/L LiCl处理的菌株疏水率下降幅度最大,约为33.13%,8 mol/L尿素处理的下降幅度最小,约为23%。这与之前的实验结果相符,LiCl法提取表层蛋白效果更好且提取表层蛋白的浓度更高导致乳杆菌的表面疏水性更低。推测表层蛋白对乳杆菌的表面疏水性及非特异性黏附有着重要的贡献。研究发现乳杆菌的疏水性通常与其粘附性之间呈现正相关[13]。Collado等[19]发现L. acidophilus等多株乳杆菌具有较高的表面疏水率,本实验结果与其一致。
表 2 不同提取方法对嗜酸乳杆菌表面疏水性的影响Table 2. Effect of different extraction methods on surface hydrophobicity of L. acidophilus组别 表面疏水率(%) 未处理 47.00 ± 4.10D 5 mol/L LiCl处理 13.87 ± 2.02A 4 mol/L盐酸胍处理 17.30 ± 7.48B 8 mol/L尿素处理 24.01 ± 1.82C 两种不同浓度LiCl处理 13.89 ± 2.39A 2.5 不同提取方法对乳杆菌表面电荷的影响
除了表面疏水性之外,菌株的表面电荷也会影响菌体的非特异性黏附。表面电荷强的菌株对肠道粘膜具有较强的黏附能力[27]。本实验测定了不同方法提取表层蛋白后菌株的表面电荷的变化,结果如表3和表4所示:未处理的L. acidophilus JCM 1132对三氯甲烷的吸附率高达90.93%,表明未处理的菌株具有很强的给电子能力。对乙酸乙酯的吸附率很弱,只有26.33%,说明其接受电子的能力很低。通过四种不同方法去除表层蛋白后,L. acidophilus JCM 1132对三氯甲烷的吸附率都有明显下降(P < 0.05),表明菌体给电子能力降低。
表 3 不同提取方法处理后嗜酸乳杆菌对三氯甲烷的吸附率Table 3. Adsorption rate of trichloromethane by L. acidophilus after different extraction methods组别 三氯甲烷吸附率(%) 未处理 90.93 ± 1.92D 5 mol/L LiCl处理 60.54 ± 2.23B 4 mol/L盐酸胍处理 69.73 ± 5.18C 8 mol/L尿素处理 56.37 ± 0.72A 两种不同浓度LiCl处理 65.95 ± 0.68C 表 4 不同提取方法处理后嗜酸乳杆菌对乙酸乙酯的吸附率Table 4. Adsorption rate of ethyl acetate by L. acidophilus after different extraction methods组别 乙酸乙酯吸附率(%) 未处理 26.33 ± 1.72B 5 mol/L LiCl处理 18.47 ± 3.16A 4 mol/L盐酸胍处理 27.00 ± 1.59B 8 mol/L尿素处理 35.31 ± 1.40C 两种不同浓度LiCl处理 16.03 ± 2.06A 然而不同方法处理后菌体对乙酸乙酯的吸附率不全是下降趋势。用4 mol/L盐酸胍和8 mol/L尿素方法处理的乳杆菌在失去表层蛋白后,对乙酸乙酯的吸附率反而升高。菌体的表面电荷不仅与表层蛋白所带电荷有关,还受到细胞壁羟基、羧基、磷酸基团等极性基团的影响,推测其原因可能是其他物质作用更能影响L. acidophilus JCM 1132表面电荷,具体机理还需要更深入探讨[25]。
孟珺等[25]提取了7株不同乳杆菌表层蛋白后发现其对三氯甲烷的吸附率明显降低,与本文实验结果一致。推测不同方法提取表层蛋白后都会影响菌体的表面电荷。由于菌体的非特异性黏附与表面疏水性和表面电荷相关,因此推测不同方法提取表层蛋白后菌体的非特异性黏附特性均会明显降低。
2.6 不同提取方法对乳杆菌自动聚集能力的影响
乳杆菌的自聚集能力和共聚集能力与其对胃肠道的黏附作用和抵抗致病菌有关。菌株的自聚集作用和黏附作用呈正相关,自聚集能力强的菌株的黏附作用强,反之,则低[28]。本实验通过四种方法去除L. acidophilus JCM 1132表层蛋白后,测定其自动聚集能力的变化也证明了表层蛋白对乳杆菌的非特异性黏附有着积极的贡献。
结果如表5所示,用四种不同方法处理后,乳杆菌自聚集率都有显著下降(P < 0.05),下降幅度约为4%~19%。其中4 mol/L盐酸胍处理后菌株的自聚集能力下降最多,下降幅度为19%。5 mol/L LiCl处理后菌株的自聚集能力下降最少,下降幅度为4%。表明不同的处理方法均能降低菌体的自聚集能力。
表 5 不同提取方法对嗜酸乳杆菌自动聚集能力的影响Table 5. Effect of different extraction methods on the autoaggregation ability of L. acidophilus组别 自动聚集能力(%) 未处理 30.55 ± 0.22E 5 mol/L LiCl处理 26.10 ± 0.80D 4 mol/L盐酸胍处理 11.10 ± 0.66A 8 mol/L尿素处理 12.85 ± 0.61B 两种不同浓度LiCl处理 19.19 ± 0.68C Chen[29]等去除L. crispatus ZJ001表层蛋白后,菌体自动聚集力和对Hela细胞的黏附力都有明显的下降趋势。Beganovic等[30]报道5 mol/L LiCl处理L. helveticus M92后,其自动聚集率下降了10%,与本实验结果一致。
2.7 不同提取方法对乳杆菌共聚集能力的影响
本实验采用致病菌Salmonella typhimurium FP1作为病原菌的代表,测定不同处理方法后对乳杆菌共聚集能力的影响。结果如表6所示:未处理前,菌体与S. typhimurium的共聚集率约为2.7%,表明该菌株与致病菌的共聚集能力较弱。用四种不同方法处理后,乳杆菌与致病菌共聚集率明显降低。其中8 mol/L尿素处理处理后的乳杆菌共聚集能力下降幅度最小,约为1.47%。两种不同浓度LiCl(5 mol/L和1 mol/L)处理的乳杆菌共聚集能力下降幅度最大,约为2.36%。表明表层蛋白参与了乳杆菌的共聚集过程。
表 6 不同处理方法对嗜酸乳杆菌共聚集能力的影响Table 6. The effect of different extraction methods on the co-aggregation ability of L. acidophilus组别 与S. typhimurium共聚集率(%) 未处理 2.70 ± 0.89B 5 mol/L LiCl处理 1.23 ± 0.13AB 4 mol/L盐酸胍处理 0.47 ± 0.16A 8 mol/L尿素处理 2.18 ± 1.34B 两种不同浓度LiCl处理 0.24 ± 0.51A Beganovic等[30]研究了LiCl处理对L. helveticus M92与S. typhimurium FP1共聚集率的影响,发现LiCl去除表层蛋白后两株菌的共聚集率下降了约7.52%,与本文的实验结果相符。
3. 结论
本实验利用5 mol/L LiCl、4 mol/L盐酸胍、8 mol/L尿素和两种不同浓度的LiCl(5 mol/L和1 mol/L)提取菌体表层蛋白。经过SDS-PAGE分析,两种不同浓度LiCl提取的表层蛋白含量显著高于其余三种方法,且有单一条带,相对分子质量在46 kDa左右。采用平板计数法测定乳杆菌致死率,结果表明四种提取方法对乳杆菌菌体的损伤都较小,不会影响到菌体的存活率。但菌体的表面疏水性、表面电荷、自聚集能力与共聚集能力都呈明显下降趋势,表明表层蛋白参与了菌体自聚集与共聚集的过程,且对菌体的非特异性黏附有积极的贡献。
-
表 1 不同提取方法对嗜酸乳杆菌存活率的影响
Table 1 Effect of different extraction methods on the survival rate of L. acidophilus
表 2 不同提取方法对嗜酸乳杆菌表面疏水性的影响
Table 2 Effect of different extraction methods on surface hydrophobicity of L. acidophilus
组别 表面疏水率(%) 未处理 47.00 ± 4.10D 5 mol/L LiCl处理 13.87 ± 2.02A 4 mol/L盐酸胍处理 17.30 ± 7.48B 8 mol/L尿素处理 24.01 ± 1.82C 两种不同浓度LiCl处理 13.89 ± 2.39A 表 3 不同提取方法处理后嗜酸乳杆菌对三氯甲烷的吸附率
Table 3 Adsorption rate of trichloromethane by L. acidophilus after different extraction methods
组别 三氯甲烷吸附率(%) 未处理 90.93 ± 1.92D 5 mol/L LiCl处理 60.54 ± 2.23B 4 mol/L盐酸胍处理 69.73 ± 5.18C 8 mol/L尿素处理 56.37 ± 0.72A 两种不同浓度LiCl处理 65.95 ± 0.68C 表 4 不同提取方法处理后嗜酸乳杆菌对乙酸乙酯的吸附率
Table 4 Adsorption rate of ethyl acetate by L. acidophilus after different extraction methods
组别 乙酸乙酯吸附率(%) 未处理 26.33 ± 1.72B 5 mol/L LiCl处理 18.47 ± 3.16A 4 mol/L盐酸胍处理 27.00 ± 1.59B 8 mol/L尿素处理 35.31 ± 1.40C 两种不同浓度LiCl处理 16.03 ± 2.06A 表 5 不同提取方法对嗜酸乳杆菌自动聚集能力的影响
Table 5 Effect of different extraction methods on the autoaggregation ability of L. acidophilus
组别 自动聚集能力(%) 未处理 30.55 ± 0.22E 5 mol/L LiCl处理 26.10 ± 0.80D 4 mol/L盐酸胍处理 11.10 ± 0.66A 8 mol/L尿素处理 12.85 ± 0.61B 两种不同浓度LiCl处理 19.19 ± 0.68C 表 6 不同处理方法对嗜酸乳杆菌共聚集能力的影响
Table 6 The effect of different extraction methods on the co-aggregation ability of L. acidophilus
组别 与S. typhimurium共聚集率(%) 未处理 2.70 ± 0.89B 5 mol/L LiCl处理 1.23 ± 0.13AB 4 mol/L盐酸胍处理 0.47 ± 0.16A 8 mol/L尿素处理 2.18 ± 1.34B 两种不同浓度LiCl处理 0.24 ± 0.51A -
[1] Palomino M M, Waehner P M, Fina MJ, et al. Influence of osmotic stress on the profile and gene expression of surface layer proteins in Lactobacillus acidophilus ATCC 4356[J]. Appl Microbiol Biotechnol,2016,100(19):8475−8484. doi: 10.1007/s00253-016-7698-y
[2] Prado AM, Ruzal S M, Cordo S M. S-layer proteins from Lactobacillus sp inhibit bacterial infection by blockage of DC-SIGN cell receptor[J]. International Journal of Biological Macromolecules,2016,92:998−1005. doi: 10.1016/j.ijbiomac.2016.07.096
[3] 占萌, 李慧臻, 王娜娜, 等. 嗜酸乳杆菌 KLDS1.0901 表层蛋白对菌株黏附特性的影响[J]. 食品工业科技,2019,40(5):144−150. [Zhan M, Li H Z, Wang N N, et al. Effect of surface layer proteins of Lactobacillus acidophilus KLDS1.0901 on its adhesion characteristics[J]. Food Industry Science and Technology,2019,40(5):144−150. [4] 李海红, 杨振泉, 王晓霖, 等. 乳酸菌表面蛋白对免疫细胞的诱导增殖及粘附抑制效应[J]. 中国微生态学杂志,2016,28(1):15−20. [Li H H, Yang Z Q, Wang X L, et al. Surface proteins of lactic acid bacteria induce the proliferation and Inhibit the adherence of immunocytes[J]. Chinese Journal of Microecology,2016,28(1):15−20. [5] 关晓燕, 罗卫东, 李丽丽, 等. 乳酸杆菌表层蛋白基因结构及功能研究进展[J]. 食品与生物技术学报,2015,34(7):678−684. [Guan X Y, Luo W D, Li L L, et al. Review on genes structures and functions of surface layer proteins from Lactobacillus spp J]. Journal of Food and Biotechnology,2015,34(7):678−684.
[6] Wang W, Shao A, Feng S, et al. Physicochemical characterization and gastrointestinal adhesion of S-layer proteins-coating liposomes[J]. International Journal of Pharmaceutics,2017,529(1-2):227−237. doi: 10.1016/j.ijpharm.2017.07.006
[7] Johnson B R, O'Flaherty S, Goh Y J, et al. The S-layer associated serine protease homolog prtX impacts cell surface-mediated microbe-host interactions of Lactobacillus acidophilus NCFM[J]. Front Microbiol,2017(8):1185.
[8] Do C F L R, Rabah H, De O C R D, et al. Extractable bacterial surface proteins in probiotic-host interaction[J]. Frontiers in Microbiology,2018(9):645.
[9] Uroić K, Novak J, Hynönen U, et al. The role of S-layer in adhesive and immunomodulating properties of probiotic starter culture Lactobacillus brevis D6 isolated from artisanal smoked fresh cheese[J]. LWT-Food Science and Technology,2016,69:623−632. doi: 10.1016/j.lwt.2016.02.013
[10] Gerbino E, Carasi P, Mobili P, et al. Role of S-layer proteins in bacteria[J]. World Journal of Microbiology and Biotechnology,2015,31(12):1877−1887. doi: 10.1007/s11274-015-1952-9
[11] Gao X, Huang L, Zhu L, et al. Inhibition of H9N2virus invasion into dendritic cells by the S-layer protein from L. acidophilus ATCC 4356[J]. Front Cell Infect Microbiol,2016,6:137.
[12] Johnson B R, Hymes J, Sanozky-Dawes R, et al. Conserved S-layer-associated proteins revealed by exoproteomic survey of S-layer-forming Lactobacilli[J]. Appl Environ Microbiol,2016,82(1):134−145. doi: 10.1128/AEM.01968-15
[13] Michon C, Langella P, Eijsink V G H, et al. Display of recombinant proteins at the surface of lactic acid bacteria: Strategies and applications[J]. Microbial Cell Factories,2016,15(1):70. doi: 10.1186/s12934-016-0468-9
[14] 尹琼芳, 潘道东, 郭宇星, 等. 嗜酸乳杆菌S-层蛋白的提取和鉴定[J]. 中国食品学报,2016,16(5):224−229. [Yin Q F, Pan D D, Guo Y X, et al. Extraction and characterization of S-layer protein from Lactobacillus acidophilus CGMCC 1.1878[J]. Chinese Journal of Food Science,2016,16(5):224−229. [15] Zhang D, Wu M, Guo Y, et al. Purification of Lactobacillus acidophilus surface-layer protein and its immunomodulatory effects on RAW264.7 cells[J]. The Science of Food and Agriculture,2017,97(12):4204−4209. doi: 10.1002/jsfa.8294
[16] Meng J, Zhang QX, Lu RR. Identification and analysis of the function of surface layer proteins from three Lactobacillus strains[J]. Annals of Microbiology,2018,68(4):207−216. doi: 10.1007/s13213-018-1335-1
[17] Kos B, Suskovic J, Vukovic S, et al. Adhesion and aggregation ability of probiotic strain Lactobacillus acidophilus M92[J]. Journal of Applied Microbiology,2003,94:981−987. doi: 10.1046/j.1365-2672.2003.01915.x
[18] 刘珊娜, 王娜, 冀博, 等. 酸菜汁来源的几株乳杆菌功能特性研究[J]. 食品科技,2019,44(1):8−13. [Liu S N, Wang N, Ji B, et al. Functional properties of several Lactobacillus strains from sauerkraut juice[J]. Food Science and Technology,2019,44(1):8−13. [19] Collado M C, Meriluoto J, Salminen S. Adhesion and aggregation properties of probiotic and pathogen strains[J]. European Food Research and Technology,2008,226(5):1065−1073. doi: 10.1007/s00217-007-0632-x
[20] Johnson B, Selle K, O'Flaherty S, et al. Identification of extracellular surface-layer associated proteins in Lactobacillus acidophilus NCFM[J]. Microbiology,2013,159:2269−2282. doi: 10.1099/mic.0.070755-0
[21] Wang H, Zhang L, Xu S, et al. Surface-layer protein from Lactobacillus acidophilus NCFM inhibits lipopolysaccharide-induced inflammation through MAPK and NF-kappaB signaling pathways in RAW264.7 cells[J]. Journal of Agricultural and Food Chemistry,2018,66(29):7655−7662. doi: 10.1021/acs.jafc.8b02012
[22] 孟珺, 王艳阳, 康媛媛, 等. 乳杆菌表层蛋白理化性质与生物功能的研究进展[J]. 河南工业大学学报(自然科学版),2020,41(4):129−138. [Meng J, Wang Y Y, Kang Y Y, et al. Advances in research on physicochemical properties and biological functions of Lactobacillus surface layer proteins[J]. Journal of Henan University of Technology (Natural Science Edition),2020,41(4):129−138. [23] Guo Y, Jiang X, Yang Y, et al. Prevention of necrotizing enterocolitis through surface layer protein of Lactobacillus acidophilus CICC6074 reducing intestinal epithelial apoptosis[J]. Journal of Functional Foods,2018,47:91−99. doi: 10.1016/j.jff.2018.05.045
[24] Lortal S, Heijenoort J V, Gruber K, et al. S-layer of Lactobacillus helveticus ATCC 12046: Isolation, chemical characterization and re-formation after extraction with lithium chloride[J]. Journal of General Microbiology,1992,138(3):611−618. doi: 10.1099/00221287-138-3-611
[25] 孟珺. 乳杆菌表层蛋白的理化性质和生物学功能研究[D]. 无锡: 江南大学, 2016. Meng J. Study of the physicochemical properties and biological functions of Lactobacillus surface layer proteins[D]. Wuxi: Jiangnan University, 2016.
[26] Perez P F, Minnaard Y, Disalvo E A, et al. Surface properties of bifidobacterial strains of human origin[J]. Applied and Environmental Microbiology,1998,64(1):21−26. doi: 10.1128/AEM.64.1.21-26.1998
[27] 杨颖, 陈卫, 张灏, 等. 植物乳杆菌 HO-69的口腔益生性质研究[J]. 华西口腔医学杂志,2008,26(5):482−489. [Yang Y, Chen W, Zhang H, et al. Probiotic characteristics of Lactobacillus plantarum HO-69 applied in oral cavity[J]. West China Journal of Stomatology,2008,26(5):482−489. doi: 10.3321/j.issn:1000-1182.2008.05.008 [28] 牛钰涵. 表层蛋白对乳杆菌益生性质的影响及其抑菌功能[D]. 无锡: 江南大学, 2019. Niu Y H. Effect of surface layer proteins from lactobacillus on the strain’s probiotic properties and their antibacterial function[D]. Wuxi: Jiangnan University, 2019.
[29] Chen X Y, Chen Y, Li X L, et al. Characterization of surface layer proteins in Lactobacillus crispatus isolate ZJ001[J]. Journal of Microbiology and Biotechnology,2009,19(10):1176−1183.
[30] Beganović J, Frece J, Kos B, et al. Functionality of the S-layer protein from the probiotic strain Lactobacillus helveticus M92[J]. Antonie Van Leeuwenhoek,2011,100(1):43−53. doi: 10.1007/s10482-011-9563-4





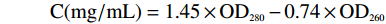






 下载:
下载:

 下载:
下载:
