Preparation of Chitosan with High Degree of Deacetylation from Amorphous Chitin
-
摘要: 对甲壳素进行超微粉碎处理,通过控制碾磨时间,得到结晶度为80.91%、58.06%、31.94%和8.09%等4种甲壳素细粉,再对其和普通粉碎甲壳素的非均相脱乙酰制备壳聚糖的反应进行对比研究。结果表明,随着甲壳素样品结晶度的降低,在相同的脱乙酰反应条件下制备的壳聚糖的脱乙酰度更高。采用单次碱处理的方式,使用普通粉碎甲壳素得到的壳聚糖脱乙酰度为84%,使用结晶度为31.94%和8.09%的甲壳素细粉,壳聚糖脱乙酰度可达90%以上。动力学研究分析,普通粉碎甲壳素和超微粉碎处理得到的4种甲壳素细粉非均相脱乙酰反应的活化能分别为58.71、47.23、42.30、35.44和31.73 kJ/mol,即反应的活化能随结晶度的降低而降低,表明非晶化处理能增强甲壳素非均相脱乙酰反应活性。Abstract: By controlling the grinding time, four kinds of chitin powders with crystallinity of 80.91%, 58.06%, 31.94% and 8.09% were obtained by superfine grinding of chitin, then the heterogeneous deacetylation reaction of them and ordinary grinding chitin was comparative studied. The results showed that the degree of deacetylation of the prepared chitosan was increased with the decrease of crystallinity of chitin. Chitosan with high degree of deacetylation (>90%) could be obtained by single alkali treatment by using chitin powder with crystallinity of 31.94% and 8.09%, and the degree of deacetylation chitosan with ordinary grinding chitin was only 84%. According to the kinetic analysis, the activation energies of heterogeneous deacetylation of chitin powder obtained by ordinary grinding and four kinds of chitin powders obtained by superfine grinding were 58.71, 47.23, 42.30, 35.44 and 31.73 kJ/mol, respectively. The activation energy of the reaction decreased with the decrease of crystallinity, which indicated that amorphous treatment could enhance the heterogeneous deacetylation activity of chitin.
-
Keywords:
- chitin /
- superfine grinding /
- amorphization /
- degree of deacetylation /
- chitosan
-
甲壳素(Chitin)由N-乙酰氨基葡萄糖通过β-1,4糖苷键聚合而成,是自然界第二丰富的有机天然多糖,广泛存在于虾、蟹等甲壳动物以及蘑菇等菌类的细胞壁中[1]。甲壳素及其衍生物具有无毒性、生物相容性和生物可降解性等多种优良性能,在食品、生物医药、材料、农业、纺织印染等领域具有广泛的应用前景[2-5]。由于甲壳素具有高度有序的晶体结构和大量的分子间和分子内氢键,难溶于水和常见的有机溶剂,其应用受到了很大的限制[6]。壳聚糖(Chitosan)是甲壳素的脱乙酰产物,是甲壳素最重要的衍生物之一,可溶解于部分稀酸中,其应用比甲壳素更为广泛[7-8]。壳聚糖的脱乙酰度(Degree of Deacetylation,DD)直接影响其溶解度、粘度、离子交换能力和絮凝性等性能,是评价壳聚糖质量的重要技术指标之一。高脱乙酰度(DD>90%)的壳聚糖不仅溶解和离子交换性能良好,还具有更优良的抑菌性[9-10]和生物相容性[11],主要应用于可食用膜[12-13]和生物医用材料[14-15]等领域,因此高脱乙酰度壳聚糖具有更高的商业价值。目前壳聚糖主要通过甲壳素非均相脱乙酰反应制备。影响壳聚糖脱乙酰度的参数主要包括反应温度、NaOH浓度和碱处理方式(处理次数)等[16]。通常为了获得高脱乙酰的壳聚糖,需要采用碱多次处理的方式[17-18],其制备工艺更为复杂。
超微粉碎(Superfine grinding)技术利用机械或流体动力的方法克服物料内部凝聚力使之破碎,将粒径3 mm以上的物料粉碎至100 μm以下,广泛应用于食品[19-21]、化工[22]、医药[23-24]等领域,超微粉碎制备的超细粉具有良好的溶解性、分散性、化学反应活性等特殊性能[25]。甲壳素经超微粉碎处理后,其粒度和结晶度均明显降低[26]。本研究以超微粉碎处理得到的甲壳素细粉为原料,非均相脱乙酰制备壳聚糖,利用超微粉碎细粉良好的化学反应活性,提高甲壳素非均相脱乙酰反应的效率,减少反应过程中碱的用量(减少排放)和简化高脱乙酰度壳聚糖的制备工艺。
1. 材料与方法
1.1 材料与仪器
α-甲壳素 大连中科格莱克生物科技有限公司,来源于阿拉斯加雪蟹(粘均分子量Mv=535 kDa,脱乙酰度DD=8.32%);其他试剂 均为AR级。
ZNC-300X碾磨式超微粉碎机 中科耐驰技术(北京)有限公司; Bettersize2600激光粒度分布仪 丹东百特仪器有限公司;D/max-2500PC X射线衍射仪 日本理学电机(RIGAKU)株式会社;101型电热鼓风干燥箱 北京市光明医疗仪器有限公司。
1.2 实验方法
1.2.1 甲壳素的超微粉碎
先将甲壳素用普通粉碎机进行粗粉碎,过筛得到60目甲壳素(命名为cht-0)。然后取400 g cht-0置于碾磨式超微粉碎机的碾磨腔中进行超微粉碎。超微粉碎机的转速设置为40 r/min,电流设置为2.5 A,每隔15 min,收集适量样品,用于后续的测试和脱乙酰反应研究。根据碾磨时间(15、30、45和60 min)的不同,总共收集得到4种甲壳素细粉,依次命名为cht-1、cht-2、cht-3和cht-4。
1.2.2 甲壳素细粉的XRD(X射线衍射)和粒径分析
甲壳素细粉(cht-1~cht-4)和60目甲壳素(cht-0)的XRD采用X射线衍射仪测定。衍射条件为Cu Kα辐射源(λ=0.1542 nm),采用石墨单色器对射线束进行单色化,管电压为50 kV,管电流200 mA,扫描步长为0.02 °,扫描范围5~60 °。甲壳素样品的结晶度按照Ioelovich[27]的方法计算。
甲壳素细粉(cht-4)的粒径使用激光粒度分布仪测定。将2 mg样品放入30 mL蒸馏水中,超声充分分散,然后逐滴加入至充满蒸馏水的样品池中。通过控制折光率来调节加入的样品量,折光率控制在10%~13%,循环水的循环速度为600 r/min。
1.2.3 甲壳素非均相脱乙酰反应制备壳聚糖及反应动力学分析
参考Chang等[28]的方法,具体如下:分别取上述得到的甲壳素粉末(cht-0~cht-4)5 g,放置于100 mL圆底烧瓶中,然后加入50 mL 40wt%的NaOH溶液(甲壳素粉末和NaOH溶液的料液比为1:10),待甲壳素分散均匀后置于一定温度(90、95和100 ℃)的油浴锅中,进行非均相脱乙酰反应。在反应时间为1、2、3和4 h取出适量的反应物,立即倒入装有200 mL蒸馏水的烧杯中,使脱乙酰反应停止。反应物用布氏漏斗抽滤,固体部分先用蒸馏水洗涤3次,再用无水乙醇洗涤2次,最后60 ℃烘干,得到壳聚糖。
1.2.4 壳聚糖脱乙酰度的测定
采用双突跃电位滴定法[29]测定壳聚糖的脱乙酰度,计算公式如下:
DD(%)=C(V2−V1)×203G+C(V2−V1)×42×100 (1) 其中:G:壳聚糖样品(130 ℃充分干燥)的质量(g);C:NaOH的浓度(mol/L);V1:第一突跃点时用去的NaOH标准溶液的体积(mL);V2:第二突跃点时用去的NaOH标准溶液的体积(mL);203:N-乙酰氨基葡萄糖(GlcNAc)的相对分子质量;42:乙酰基的相对分子质量。
1.3 数据处理
实验重复3次,数据以
ˉX 表示,采用Excel 2007对数据进行方差分析,Origin 6.0软件绘图。2. 结果与分析
2.1 超微粉碎甲壳素的制备和分析
采用XRD分析了甲壳素粉末(cht-0~cht-4)的结晶行为,其谱图见图1。由图1可知,随着超微粉碎处理时间的增加,甲壳素在9.2 °处的(020)面和19.2 °处的(110)面的两个特征尖峰的强度逐渐降低,说明其微观结构已经破坏[30]。甲壳素粉末cht-0的结晶度经计算为96.14%,随着超微粉碎处理,甲壳素的结晶度逐渐降低,最后得到的甲壳素细粉cht-4的结晶度仅为8.09%,接近于完全非晶化的甲壳素。结晶度降低的原因是碾磨削弱了甲壳素的氢键网络[31]。
采用激光粒度分布仪分析甲壳素细粉cht-4的粒径分布,其粒径分布图见图2(其中累积分布表示小于某颗粒粒径的百分含量;区间分布表示粒径区间中某颗粒的百分含量)。甲壳素细粉cht-4的体积平均径为41.44 μm,小于60目甲壳素cht-0粒径(250 μm)的五分之一,90%的粒径低于96.33 μm,已达到超微粉碎的级别。
2.2 甲壳素非均相脱乙酰制备壳聚糖
不同反应温度和反应时间得到壳聚糖产品的脱乙酰度见表1。由表1可知,随着甲壳素样品结晶度的降低,在相同的反应条件下(反应温度和时间),其制备的壳聚糖的脱乙酰度更高。其中非晶化程度高的甲壳素细粉cht-3和cht-4,经单次碱处理即可得到脱乙酰度90%以上的壳聚糖,可以大幅降低整个脱乙酰过程中碱的用量,简化生产工艺。
表 1 不同反应温度和反应时间得到壳聚糖的脱乙酰度(%)Table 1. Degree of deacetylation of chitosan obtained at different reaction temperature and time(%)反应温度 反应时间 样品名 cht-4 cht-3 cht-2 cht-1 cht-0 90 ℃ 1 h 63.10±0.43 60.10±0.46 57.63±0.42 56.53±0.39 53.61±0.39 2 h 78.24±0.46 75.4±0.51 69.09±0.56 66.89±0.49 65.11±0.48 3 h 84.35±0.54 81.64±0.68 76.76±0.58 74.52±0.58 70.49±0.54 4 h 89.87±0.61 85.52±0.62 80.52±0.63 77.86±0.60 74.08±0.55 95 ℃ 1 h 66.98±0.45 64.06±0.51 61.67±0.49 59.27±0.42 57.61±0.49 2 h 82.38±0.57 77.87±0.59 73.68±0.56 72.91±0.52 67.43±0.51 3 h 89.35±0.61 85.07±0.52 80.97±0.52 78.93±0.52 75.63±0.59 4 h 92.57±0.38 88.36±0.52 84.69±0.60 83.21±0.59 78.96±0.61 100 ℃ 1 h 67.32±0.40 64.97±0.48 62.42±0.45 61.28±0.43 59.68±0.39 2 h 81.47±0.61 80.08±0.56 77.13±0.56 74.72±0.58 70.29±0.48 3 h 91.16±0.57 87.81±0.56 84.43±0.58 82.52±0.54 80.76±0.56 4 h 93.48±0.46 91.02±0.49 88.00±0.52 86.26±0.61 84.00±0.52 2.3 反应动力学分析
甲壳素的非均相脱乙酰反应是与NaOH和乙酰氨基的浓度相关的二级反应,但由于NaOH是远过量的,通常认为甲壳素的脱乙酰反应为准一级反应[32](只与乙酰氨基的浓度相关),速率常数与脱乙酰度的关系可以表示为:
−ln(1−DD)=kt (2) 式中:DD为反应产物的脱乙酰度(%);t为反应时间(min);k为反应速率常数(min−1)。
分别对不同结晶度的甲壳素在90 、95 和100 ℃反应温度下的脱乙酰产物的−ln(1−DD)对反应时间t作图,得到图3,图中直线的斜率即为甲壳素的脱乙酰反应速率,表观一级反应速率常数见表2。
表 2 甲壳素脱乙酰反应的表观一级反应速率常数Table 2. Apparent first order rate constants of deacetylation of chitin甲壳素样品 温度(℃) 速率常数k(min−1) 决定系数(R2) cht-0 90 3.19×10−3 0.9665 95 3.99×10−3 0.9834 100 5.35×10−3 0.9793 cht-1 90 3.81×10−3 0.9814 95 4.85×10−3 0.9791 100 5.80×10−3 0.9856 cht-2 90 4.36×10−3 0.9852 95 5.13×10−3 0.9866 100 6.35×10−3 0.9811 cht-3 90 5.56×10−3 0.9719 95 6.29×10−3 0.9807 100 7.62×10−3 0.9437 cht-4 90 7.01×10−3 0.9924 95 8.30×10−3 0.9857 100 9.29×10−3 0.9775 根据阿伦尼乌斯(Arrhenius)公式计算甲壳素的脱乙酰活化能:
lnk=−EaRT+B (3) 式中,k为反应速率常数;Ea为反应活化能(J/mol); R为通用气体常数,8.314 J/(mol·K);T为热力学温度(K)。
分别对不同结晶度的甲壳素的ln k对-1/RT作图,即可求得反应的活化能。如图4所示,甲壳素(cht-0~cht-4)对应的脱乙酰反应活化能分别为58.17、47.23、42.30、35.44和31.73 kJ/mol,表明随着甲壳素样品结晶度的降低,其非均相脱乙酰的反应活性增强。
2.4 非晶化对甲壳素非均相脱乙酰反应的影响分析
根据文献[28,33-34]报道,甲壳素分子链表面的NaOH的浓度是影响脱乙酰效率的主要因素(甲壳素脱乙酰反应历程如图5所示,其中第(1)步反应是可逆过程,需要克服一定的活化能,是整个反应的控速步骤[35])。随着脱乙酰反应的进行,NaOH能与低分子电解质(脱乙酰产物)以及多糖分子会形成溶剂化结构,导致甲壳素分子链表面NaOH的浓度降低,脱乙酰反应难以继续进行[36]。因此,即使提高NaOH的浓度和反应温度,也很难直接得到高脱乙酰度壳聚糖。通常需要多次碱处理减少低分子电解质的含量和溶剂化结构,来实现高脱乙酰度壳聚糖的制备[17-18]。
甲壳素经超微粉碎非晶化处理后,结晶度的降低提高了反应产物的扩散速度,有利于乙酰基的脱落和低分子电解质向溶剂中运输,减少反应过程中形成的溶剂化结构,减缓甲壳素分子链表面NaOH的浓度降低速率,从而提高脱乙酰反应的效率(降低反应活化能)。非晶化程度高的甲壳素样品(cht-3、cht-4)经单次碱处理,即可得到高脱乙酰度(DD>90%)壳聚糖。
3. 结论
高脱乙酰度壳聚糖通常需要采用甲壳素经多次碱处理的工艺制备。本研究提供了一种通过超微粉碎处理甲壳素,使其非晶化后再脱乙酰制备壳聚糖的技术路线。非晶化程度高的甲壳素,经过单次碱处理即可得到高脱乙酰度(DD>90%)壳聚糖,可以大幅降低脱乙酰反应过程中碱的用量,简化生产工艺,具有良好的应用前景。
-
表 1 不同反应温度和反应时间得到壳聚糖的脱乙酰度(%)
Table 1 Degree of deacetylation of chitosan obtained at different reaction temperature and time(%)
反应温度 反应时间 样品名 cht-4 cht-3 cht-2 cht-1 cht-0 90 ℃ 1 h 63.10±0.43 60.10±0.46 57.63±0.42 56.53±0.39 53.61±0.39 2 h 78.24±0.46 75.4±0.51 69.09±0.56 66.89±0.49 65.11±0.48 3 h 84.35±0.54 81.64±0.68 76.76±0.58 74.52±0.58 70.49±0.54 4 h 89.87±0.61 85.52±0.62 80.52±0.63 77.86±0.60 74.08±0.55 95 ℃ 1 h 66.98±0.45 64.06±0.51 61.67±0.49 59.27±0.42 57.61±0.49 2 h 82.38±0.57 77.87±0.59 73.68±0.56 72.91±0.52 67.43±0.51 3 h 89.35±0.61 85.07±0.52 80.97±0.52 78.93±0.52 75.63±0.59 4 h 92.57±0.38 88.36±0.52 84.69±0.60 83.21±0.59 78.96±0.61 100 ℃ 1 h 67.32±0.40 64.97±0.48 62.42±0.45 61.28±0.43 59.68±0.39 2 h 81.47±0.61 80.08±0.56 77.13±0.56 74.72±0.58 70.29±0.48 3 h 91.16±0.57 87.81±0.56 84.43±0.58 82.52±0.54 80.76±0.56 4 h 93.48±0.46 91.02±0.49 88.00±0.52 86.26±0.61 84.00±0.52 表 2 甲壳素脱乙酰反应的表观一级反应速率常数
Table 2 Apparent first order rate constants of deacetylation of chitin
甲壳素样品 温度(℃) 速率常数k(min−1) 决定系数(R2) cht-0 90 3.19×10−3 0.9665 95 3.99×10−3 0.9834 100 5.35×10−3 0.9793 cht-1 90 3.81×10−3 0.9814 95 4.85×10−3 0.9791 100 5.80×10−3 0.9856 cht-2 90 4.36×10−3 0.9852 95 5.13×10−3 0.9866 100 6.35×10−3 0.9811 cht-3 90 5.56×10−3 0.9719 95 6.29×10−3 0.9807 100 7.62×10−3 0.9437 cht-4 90 7.01×10−3 0.9924 95 8.30×10−3 0.9857 100 9.29×10−3 0.9775 -
[1] Younes I, Rinaudo M. Chitin and chitosan preparation from marine sources. Structure, properties and applications[J]. Marine Drugs,2015,13(3):1133−1174. doi: 10.3390/md13031133
[2] Duan B, Huang Y, Lu A, et al. Recent advances in chitin based materials constructed via physical methods[J]. Progress in Polymer Science,2018,82:1−33. doi: 10.1016/j.progpolymsci.2018.04.001
[3] Sun C, Fu D, Jin L, et al. Chitin isolated from yeast cell wall induces the resistance of tomato fruit to Botrytis cinerea[J]. Carbohydrate Polymers,2018,199:341−352. doi: 10.1016/j.carbpol.2018.07.045
[4] Deepthi S, Venkatesan J, Kim S K, et al. An overview of chitin or chitosan/nano ceramic composite scaffolds for bone tissue engineering[J]. International Journal of Biological Macromolecules,2016,93(Pt B):1338−1353.
[5] Song S, Zhao Y, Yuan X, et al. β-Chitin nanofiber hydrogel as a scaffold to in situ fabricate monodispersed ultra-small silver nanoparticles[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects,2019,574:36−43.
[6] Bedian L, Villalba-Rodriguez A M, Hernandez-Vargas G, et al. Bio-based materials with novel characteristics for tissue engineering applications - A review[J]. International Journal of Biological Macromolecules,2017,98:837−846. doi: 10.1016/j.ijbiomac.2017.02.048
[7] Muxika A, Etxabide A, Uranga J, et al. Chitosan as a bioactive polymer: Processing, properties and applications[J]. International Journal of Biological Macromolecules,2017,105(Pt 2):1358−1368.
[8] Shariatinia Z. Pharmaceutical applications of chitosan[J]. Advances in Colloid and Interface Science,2019,263:131−194. doi: 10.1016/j.cis.2018.11.008
[9] Verlee A, Mincke S, Stevens C V. Recent developments in antibacterial and antifungal chitosan and its derivatives[J]. Carbohydrate Polymers,2017,164:268−283. doi: 10.1016/j.carbpol.2017.02.001
[10] 俞娟, 徐俊华, 范一民. 壳聚糖抗菌性能研究进展[J]. 林业工程学报,2018,3(5):20−27. [11] Cheung R C, Ng T B, Wong J H, et al. Chitosan: An update on potential biomedical and pharmaceutical applications[J]. Marine Drugs,2015,13(8):5156−5186. doi: 10.3390/md13085156
[12] 张立挺, 蒋子文, 高磊, 等. 壳聚糖明胶可食用复合膜的制备与抗菌性能研究[J]. 食品研究与开发,2020,41 (6):106−111. [13] 史建如, 孙永, 刘楠, 等. 壳聚糖基褐藻多酚可食膜的制备工艺优化[J]. 南方农业学报,2018,49(5):979−985. doi: 10.3969/j.issn.2095-1191.2018.05.22 [14] 邹圣灿, 林莎莎, 王宝群, 等. 壳聚糖止血海绵的制备及其性能[J]. 纺织导报,2019(3):75−77. [15] 郑磊, 崔慧斐. 不同分子量和脱乙酰度壳聚糖用作组织工程材料的性质评价[J]. 中国生化药物杂志,2009,30(2):106−110. [16] 吕全建, 王建玲, 姬小明, 等. 影响壳聚糖脱乙酰度的因素研究[J]. 安徽农业科学,2008,36(16):6615−6616. doi: 10.3969/j.issn.0517-6611.2008.16.005 [17] 朱昌玲, 孙达峰, 张洁, 等. 高脱乙酰度壳聚糖制备工艺研究[J]. 中国野生植物资源,2011,30(6):44−47. doi: 10.3969/j.issn.1006-9690.2011.06.010 [18] 赵维, 李建科. 高脱乙酰度蛹渣壳聚糖制备工艺优化[J]. 食品科学,2010,31(20):121−126. [19] Gao X, Zhu D, Liu Y, et al. Physicochemical properties and anthocyanin bioaccessibility of downy rose-myrtle powder prepared by superfine grinding[J]. International Journal of Food Properties,2019,22(1):2022−2032. doi: 10.1080/10942912.2019.1702999
[20] 郭妍婷, 黄雪, 陈曼, 等. 超微粉碎技术在食品加工中的应用[J]. 仲恺农业工程学院学报,2017,30(3):60−64. doi: 10.3969/j.issn.1674-5663.2017.03.013 [21] 郭妍婷, 黄雪, 陈曼, 等. 超微粉碎技术的应用研究进展[J]. 广东化工,2016,43(16):276−277. doi: 10.3969/j.issn.1007-1865.2016.16.141 [22] Wang Z, Hong C, Xing Y, et al. Influences of ultrafine comminution on chemical properties of antibiotic bioferment residue[J]. Powder Technology,2017,321:514−522. doi: 10.1016/j.powtec.2017.08.003
[23] Augusto-Obara T R, Oliveira J D, Gloria E M D, et al. Benefits of superfine grinding method on antioxidant and antifungal characteristic of Brazilian green propolis extract[J]. Scientia Agricola,2019,76(5):398−404. doi: 10.1590/1678-992x-2018-0056
[24] 李婧琳, 王媚, 史亚军, 等. 超微粉碎技术在中药制剂中的应用分析[J]. 现在中医药,2018,38(5):121−123. [25] Wu M, Gao F, Yin D M, et al. Processing of Superfine grinding corn straw fiber-reinforced starch film and the enhancement on its mechanical properties[J]. Polymers (Basel),2018,10(8).
[26] Zhang W, Zhao Y, Xu L, et al. Superfine grinding induced amorphization and increased solubility of alpha-chitin[J]. Carbohydrate Polymers,2020,237:116145. doi: 10.1016/j.carbpol.2020.116145
[27] Ioelovich M. Crystallinity and hydrophility of chitin and chitosan[J]. Journal of Chemistry,2014,3(3):7−14.
[28] Chang K L B, Tsai G, Lee J, et al. Heterogeneous N-deacetylation of chitin in alkaline solution[J]. Carbohydrate Research,1997(303):327−332.
[29] 徐文峰, 廖晓玲. 碱量法测定壳聚糖脱乙酰度的研究[J]. 分析试验室,2008,27(增刊):218−221. [30] Cárdenas G, Cabrera G, Taboada E, et al. Chitin characterization by SEM, FTIR, XRD, and13C cross polarization/mass angle spinning NMR[J]. Journal of Applied Polymer Science,2004,93(4):1876−1885. doi: 10.1002/app.20647
[31] Margoutidis G, Parsons V H, Bottaro C S, et al. Mechanochemical amorphization of α-chitin and conversion into oligomers of N-Acetyl-d-glucosamine[J]. ACS Sustainable Chemistry & Engineering,2018,6(2):1662−1669.
[32] 刘廷国, 李斌, 刘晶, 等. 甲壳素非均相脱乙酰的低温反应动力学研究[J]. 食品工业科技,2009,30(10):80−84. [33] Ottoy M H, Varum K M, Smidsrod O. Compositional heterogeneity of heterogeneously deacetylated chitosans[J]. Carbohydrate Polymers,1996,29(1):17−24. doi: 10.1016/0144-8617(95)00154-9
[34] Yaghobi N, Mirzadeh H. Enhancement of chitin's degree of deacetylation of multistage alkali treatments[J]. Iranian Polymer Journal,2004,13(2):131−136.
[35] 张子涛, 陈东辉, 陈亮. 甲壳素脱乙酰化及其动力学[J]. 青岛大学学报,2000,15(4):23−26. [36] Chebotok E N, Novikov V Y, Konovalova I N. Kinetics of base deacetylation of chitin and chitosan as influenced by their crystallinity[J]. Russian Journal of Applied Chemistry,2007,80(10):1753−1758. doi: 10.1134/S1070427207100321






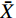

 下载:
下载:






 下载:
下载:
