Extraction Process Optimization, Composition Analysis of Essential Oil from Chimonanthus nitens Oliv and Its Antioxidant Activity
-
摘要: 目的:优选黄金茶挥发油提取的最佳工艺,并对黄金茶挥发油进行成分分析、抗氧化研究。方法:通过正交试验设计优化微波辅助水蒸气蒸馏法提取挥发油工艺;通过气相色谱-质谱(GC-MS)分析黄金茶挥发油的化学成分;以DPPH自由基、还原力和金属离子螯合能力为指标评价黄金茶挥发油的体外抗氧化能力。结果:微波辅助水蒸气蒸馏法提取黄金茶挥发油的最优工艺为微波时间10 min,料液比1: 25 g/mL,水蒸气蒸馏时间5 h,在此条件下提取黄金茶挥发油得率为1.7792%。黄金茶挥发油中鉴定出21种化学物质,其中成分主要为酯类和萜类化合物,(1-甲基-4-丙-1-烯-2-基环己基)乙酸酯的含量达到50.67%,其次是α-蒎烯(6.92%)、α-乙酸松油酯(5.77%)、环氧化蛇麻烯II(3.96%)、伪柠檬烯(3.21%)、右旋大根香叶烯(3.12%)等。抗氧化实验显示黄金茶挥发油具有抗氧化作用,清除DPPH自由基的IC50为81.6 mg/mL,在10 mg/mL时与阳性对照BHT还原力接近,对金属离子螯合能力的半数抑制浓度为17.16 mg /mL。结论:本文采用微波辅助水蒸气蒸馏法对黄金茶挥发油的提取条件进行了优化,通过GC-MS分析了黄金茶挥发油的成分,并证实该挥发油具有抗氧化作用。
-
关键词:
- 微波辅助水蒸气蒸馏法 /
- 黄金茶 /
- 挥发油 /
- 气相色谱-质谱法(GC-MS) /
- 抗氧化活性
Abstract: Objective: The present study aimed to optimize the extraction process and evaluate the constituents, antioxidant properties of essential oil from Chimonanthus nitens Oliv. Methods: The microwave-assisted steam distillation extraction of essential oil from Chimonanthus nitens Oliv was optimized by orthogonal design, and the extraction rate of the essential oil from Chimonanthus nitens Oliv was employed as the index to evaluate the optimum process. Subsequently, gas chromatography-mass spectrometry (GC-MS) was applied to determine the chemical components of the essential oil of Chimonanthus nitens Oliv. In addition, the antioxidant activity of the essential oil was evaluated by taking 1, 1-diphenyl-2-picrylhydrazyl (DPPH) radical, reducing power and chelating ability of metal ions as indicators. Results: The optimal extraction extraction conditions were microwave time 10 min, ratio of material to liquid 1:25 g/mL, steam distillation time 5 h. In this contions, the extraction rate of the essential oil from Chimonanthus nitens Oliv was 1.7792%. Furthermore, a total of 21 chemical compounds were identified in the essential oil of Chimonanthus nitens Oliv, which contained lipids and terpenoid, among them, (1-methyl-4-propyl-1-ene-2-cyclohexyl) acetate was 50.67%, followed by α-pinene (6.92%), α-terpinyl acetate (5.77%), humulene epoxide II (3.96%), pseudolimonen (3.21%) and germacrene D (3.12%). Moreover, antioxidant activity analysis indicated that the essential oil from Chimonanthus nitens Oliv possessed certain antioxidant activity. Briefly, the IC50 of the essential oil ivolved in the DPPH free radical scavenging assay, was 81.6 mg/mL. Furthermore, the reduction force of the essential oil could be achieved to the level of the positive control group, when its concentration was 10 mg/mL, and the half inhibition concentration of the chelating ability of metal ions was 17.16 mg/mL. Conclusion: In this paper, the microwave-assisted steam distillation extraction of essential oil from Chimonanthus nitens Oliv was optimized, the chemical components of the essential oil of Chimonanthus nitens Oliv was analyzed by GC-MS, and its antioxidant activity was demonstrated in this work. -
山腊梅常见于安徽、江苏、江西、福建和贵州等地,是江西省上饶市婺源县山区特色资源[1]。山蜡梅的嫩叶,可经加工制作而成的功能性绿茶,因资源珍稀、功效奇特,被誉为“绿叶黄金”,命名为黄金茶。黄金茶为不发酵茶,通过揉捻等工艺制得,民间一直将其作为清凉解暑,健胃消食,治腹胀痛,止咳除烦的“药食同源”的天然食材,经常饮用对身体具有一定的防护作用,现代临床实验证实,黄金茶具有良好的止咳平喘、免疫调节、促进消化、减少体脂等作用[2]。黄金茶的活性成分繁复,主要含有挥发油、多糖、生物碱、黄酮、香豆素、鲨肌醇、东莨菪苷、异嗪皮啶等物质。黄金茶香味浓郁,挥发油含量高,被认为是黄金茶中的主要活性成分[3]。目前有关茶饮品的活性功能研究中,抗氧化能力是体现其功效的重要指标[4]。大量研究已证实,有效清除自由基,抑制活性氧的形成的作用,是绿茶多种活性功能的物质基础[5]。然而国内外对黄金茶挥发油的抗氧化活性研究未见报道。
目前,挥发油的提取方法研究较多,如水蒸气蒸馏法[6]、同时蒸馏萃取法[7]、超临界流体萃取[8]、固相微萃取技术[9]等。常规提取黄金茶挥发油的方法主要集中在水蒸气蒸馏法,此方法设备要求不高,操作简单,但得率较低[10-11]。同时蒸馏萃取法优点是实验简单,操作方便,溶剂用量较少,安全环保,缺点是试验所需温度较高,挥发油部分成分易挥发,且挥发油组分复杂,当蒸馏温度过高时,样品会发生水解、氧化或热分解现象[12]。超临界流体萃取法是比较新颖和热门的提取方法,提取得率较高,但设备要求也较高,生产会比较受到限制[13-14]。微波辅助水蒸气蒸馏法被定义为从植物中提取挥发油的一种替代方法,微波辅助萃取具有诸多优点,选择性高、溶剂消耗量少等,且易于操作,适用面较广[15-16],但微波辅助水蒸气蒸馏法提取黄金茶挥发油相关研究未见文献报道用。
因此,本文主要研究在微波辅助水蒸气蒸馏法提取过程中微波时间、料液比和水蒸气蒸馏时间对黄金茶挥发油得率的影响,从而选出提取黄金茶挥发油最佳工艺。并且,本实验在金茶挥发油提取工艺优化的基础上,应用GC-MS对黄金茶挥发油的化学成分进行分析同时,进一步研究黄金茶挥发油的抗氧化作用,旨在为黄金茶的综合利用提供新的技术支撑和理论参考。
1. 材料与方法
1.1 材料与仪器
黄金茶 由江西省婺源婺源县龙坞山蜡梅专业合作社于2019年6月采摘山腊梅嫩叶,并制备而成;1,1-二苯基-2-三硝基苯肼(DPPH)、2,6-二叔丁基-4-甲基苯酚(BHT) 购于美国Sigma公司;正己烷、无水硫酸钠、无水乙醇、铁氰化钾、磷酸盐缓冲液、三氯乙酸、三氯化铁、乙二胺四乙酸二钠、硫酸亚铁、氯化钠、菲啰嗪 均为国产分析纯,购于西陇化工股份有限公司。
METTLER TOLEDO AL104电子天平 上海梅特勒-托利多仪器有限公司;Anke TGL-16G-A高速台式冷冻离心机 上海安亭科学仪器厂;M1-L201B型微波炉 美的制冷家电集团;SKM型数显恒温电热套 山东鄄城华鲁电热仪器有限公司;U-T6紫外可见分光光度计 屹谱仪器制造(上海)有限公司;Milli-Q plus超纯水仪 购于美国Millipore公司;7890A-5975C GC-M联用仪 安捷伦科技有限公司。
1.2 实验方法
1.2.1 黄金茶挥发油的制备
称取40 g黄金茶样品,超纯水浸泡后微波处理,待冷却后应用于水蒸气蒸馏法提取,分别以微波时间(5、10、15、20和25 min)、料液比(1:20、1:25、1:30、1:35和1:40 g/mL)和水蒸气蒸馏时间(2、3、4、5和6 h)的3个因素进行试验,考察单因素对微波辅助水蒸气蒸馏法提取黄金茶挥发油的影响。提取过程中保持微沸状态,收集馏出液,加入无水硫酸钠进行干燥,得到黄金茶挥发油,计算得率。
1.2.2 单因素实验
1.2.2.1 微波时间对黄金茶挥发油得率的影响
称取40 g黄金茶样品,在超纯水中用料液比1:30 g/mL浸泡,分别以微波时间(5、10、15、20和25 min)对样品进行微波处理,待冷却后采用水蒸气蒸馏法提取4 h,考察微波时间对微波辅助水蒸气蒸馏法提取黄金茶挥发油的影响。
1.2.2.2 料液比对黄金茶挥发油得率的影响
称取40 g黄金茶样品,在超纯水中用料液比(1:20、1:25、1:30、1:35和1:40 g/mL)浸泡,微波处理10 min,待冷却后采用水蒸气蒸馏法提取4 h,考察料液比对微波辅助水蒸气蒸馏法提取黄金茶挥发油的影响。
1.2.2.3 水蒸气蒸馏时间对黄金茶挥发油得率的影响
称取40 g黄金茶样品,在超纯水中用料液比1:30 g/mL浸泡,微波处理10 min,待冷却后采用水蒸气蒸馏法提取2、3、4、5和6 h,考察水蒸气蒸馏时间对微波辅助水蒸气蒸馏法提取黄金茶挥发油的影响。
1.2.3 正交试验
在单因素实验结果的基础上,采用L9(34)正交试验来确定微波辅助水蒸气蒸馏法提取黄金茶挥发油的最佳生产工艺,试验因素为微波时间、料液比和水蒸气蒸馏时间。试验设计如表1所示。正交试验完成后进行验证试验,分别称取黄金茶3份,根据优化提取工艺验证,计算其挥发油得率,取三次平均值与正交试验结果比较,得到的挥发油在0~4 ℃下保存备用。
表 1 正交试验因素与水平设计Table 1. Orthogonal experimental factors and levels水平 因素 A微波时间(min) B料液比(g/mL) C水蒸气蒸馏时间(h) 1 5 1:25 4 2 10 1:30 5 3 15 1:35 6 1.2.4 黄金茶挥发油得率的计算
W(%)=m1m0×100 式中,m1:黄金茶挥发油重量,g;m0:黄金茶重量,g;W,黄金茶挥发油得率,%。
1.2.5 GC-MS分析黄金茶挥发油组成
1.2.5.1 样品的前处理
精密量取最优工艺条件下制备的黄金茶挥发油7.5 µL,加入1.5 mL正己烷,并用无水硫酸钠除水,5000 r/min离心10 min,取上清液得到待测溶液,通过0.22 μm有机滤膜过滤后直接进样分析。
1.2.5.2 色谱条件
HP-5 MS毛细管色谱柱(250 μm×30 m, 0.25 μm),载气为高纯氮气,柱流量为1.0 mL·min−1,进样量为1 μL,分流进样,分流比20:1,进样口温度280 ℃,升温程序:柱温70 ℃,保持2 min,10 ℃·min−1的速率升至100 ℃,随后以2 ℃·min−1的速率升至123 ℃并保持3 min,再以5 ℃·min−1的速率升至160 ℃,10 ℃·min−1的速率升至220 ℃,2 ℃·min−1的速率升至230 ℃并保持5 min。
1.2.5.3 质谱条件
接口温度280 ℃,电子轰击(EI)能量70 eV,离子源温度230 ℃,MS回级杆温度150 ℃溶剂延迟7 min,全扫描,质荷比20~500 amu。结合 NIST数据库并查阅文献对挥发油组分进行鉴定,采用峰面积归一化法计算各组分的相对百分含量。
1.2.6 黄金茶挥发油抗氧化活性测定
1.2.6.1 对DPPH自由基的清除作用
参考尹术华等[17]和Nuengchamnong等[18],现配浓度为2×10−4 mol/L的DPPH自由基溶液,取最优工艺条件下制备的黄金茶挥发油和BHT分别用无水乙醇稀释为10.00、20.00、40.00、60.00、80.00和100.00 mg/mL待测液,分别取0.05 mL样品溶液加入2 mL EP管中,然后加入0.2 mL DPPH自由基溶液,再加入0.05 mL乙醇涡旋混匀,避光30 min,517 nm测定吸光度值A,记为A2;对照组将0.2 mL DPPH自由基溶液更换为0.2 mL乙醇进行试验,517 nm测定吸光度值A,记为A1;空白组将0.05 mL黄金茶挥发油更换为0.05 mL乙醇进行试验,517 nm测定吸光度值A,记为A0。
根据公式计算清除率I(%):
I(\%)=(1−A2−A1 A0)×100 1.2.6.2 还原力的测定
参考Zhao等[19]和吴杨洋等[20],测定前将最优工艺条件下制备的黄金茶挥发油、BHT分别用无水乙醇稀释成10.0、20.0、30.0、40.0和50.0 mg/mL浓度的待测液。把0.75 mL的1%的铁氰化钾溶液、0.75 mL的0.2 mol/L磷酸盐缓冲液(pH6.6)和0.75 mL的待测液相互混合,在向其中加入0.75 mL的10%的三氯乙酸,在4 ℃的条件下离心10 min(3000 r/min)。离心后取1.5 mL上清液,加入1.5 mL的蒸馏水和0.1%的三氯化铁溶液,完全混匀后,在室温下静置反应10 min。然后在700 nm处测定其吸光度,记录吸光度值为A,用蒸馏水做空白调零。
1.2.6.3 金属离子螯合能力
参考刘琼等[21]实验,最优工艺条件下制备的黄金茶挥发油用无水乙醇稀释成5.0、10.0、20.0、30.0和40.0 mg/mL 浓度的黄金茶挥发油待测液,乙二胺四乙酸二钠(C10H14N2O8Na2)用超纯水稀释成5.0、10.0、20.0、30.0和40.0 mg/mL浓度的乙二胺四乙酸二钠待测液,分别配好实验使用试剂,50 μmol/L的FeSO4溶液、0.15 mol/L的NaCl溶液和300 μmol/L的菲啰嗪。分别取0.2 mL待测液加入4 mL EP管中,依次加入0.2 mL FeSO4溶液、1.4 mL NaCl溶液和0.2 mL菲啰嗪,混匀,静置10 min,562 nm处测定吸光值A2;对照组将0.2 mL待测液更换为0.2 mL超纯水进行试验,562 nm处测定吸光值A0;空白组将0.2 mL菲啰嗪更换为0.2 mL NaCl溶液进行试验,562 nm处测定吸光值A1。
根据公式计算样品对金属铁离子的螯合活性I(%):
I(\%)=(1−A2−A1 A0)×100 1.3 数据处理
采用Excel、SPSS 22.0软件处理和分析微波辅助水蒸气蒸馏法提取黄金茶挥发油实验中所得数据,并作图。
2. 结果与分析
2.1 单因素实验结果
2.1.1 微波时间的确定
由图1可知,随着微波时间的增加,黄金茶挥发油得率有所增加,但幅度不大。当微波时间超过10 min之后,黄金茶挥发油得率缓慢降低,微波时间为25 min时,得率快速下降。这可能是因为微波对黄金茶茶叶细胞破坏其细胞膜的作用,微波处理时间越长,细胞被破坏的程度就越大,被释放到环境中的活性化合物也越多,从而挥发油得率增加。但当处理黄金茶挥发油的微波时间超过10 min之后,由于内部过热,极性水导致植物体内的压力梯度增加细胞被剧烈破坏,细胞壁破裂,从而油更容易被释放到周围溶液当中去,从而降低了黄金茶挥发油得率[22]。因此最佳微波时间为10 min。
2.1.2 料液比的确定
从图2可知,料液比越高,黄金茶挥发油得率越高,但料液比超过1:30时,黄金茶挥发油得率降低。这是因为料液比较低时,茶叶与水接触面积较小,浸润度较低,不利于挥发油释放,导致得率较低,也容易发现结焦现象。随着料液比的增加,更多的极性水进入黄金茶茶叶细胞,水在加热时迅速升温,加快细胞破裂使得挥发油能较多的被水蒸气带出,得率增加。但当料液比过高时,黄金茶挥发油在水中的溶解变大,导致部分油损失在水介质中,且液面过厚也会影响微波的吸收[22]。因此最佳料液比为1:30。
2.1.3 水蒸气蒸馏时间的确定
由图3可知,随着水蒸气蒸馏时间的增加,黄金茶挥发油得率增加。当水蒸气蒸馏时间超过5 h之后,黄金茶挥发油得率降低。结合文献报道[23],推测随着时间的增加,黄金茶挥发油不断的随着水蒸气从黄金茶茶叶中分离出来,但过长的时间导致挥发油被破坏或除介质,使得黄金茶挥发油得率下降。因此,最佳水蒸气蒸馏时间为5 h。
2.2 正交试验结果分析
以黄金茶挥发油得率为评价指标,每次试验重复三次,取平均值。通过表2可知,微波时间对挥发油得率影响最大,其他依次是水蒸气蒸馏时间、料液比,最佳工艺是A2B2C2,即微波时间10 min,料液比1:25 g/mL,水蒸气蒸馏时间5 h。由表3可知,微波时间、水蒸气蒸馏时间对试验结果影响极显著(P<0.01),这与极差分析结果一致。根据优化提取工艺验证,挥发油得率分别为1.7987%、1.7684%、1.7706%,平均值为1.7792%,高于正交试验结果,重现性好,确定优化提取工艺为A2B2C2。
表 2 正交试验结果与分析Table 2. Results and analysis of orthogonal test试验号 A微波时间(min) B料液比(g/mL) C水蒸气蒸馏时间(h) 挥发油得率(%) 1 1 1 1 1.2385 2 1 2 2 1.4191 3 1 3 3 1.1591 4 2 1 2 1.7409 5 2 2 3 1.5185 6 2 3 1 1.5637 7 3 1 3 1.0675 8 3 2 1 1.2484 9 3 3 2 1.3247 K1 3.82 4.05 4.05 K2 4.82 4.19 4.48 K3 3.64 4.05 3.75 k1 1.27 1.35 1.35 k2 1.61 1.40 1.49 k3 1.21 1.35 1.25 R 0.39 0.05 0.25 主次顺序 A>C>B 优水平 A2 B2 C2 优组合 A2B2C2 表 3 正交试验方差分析结果Table 3. Tests of Between-Subjects effects方差来源 偏差平方和 自由度 均方 F值 显著性 修正模型 3.68×10−3a 6 6.10×10−5 73.26 1.40×10−5 截距 16.76 1 16.76 20029.70 0.00 A 2.71×10−3 2 1.36×10−3 162.18 6.00×10−6** B 4.00×10−6 2 2.00×10−6 2.56 0.28 C 9.20×10−5 2 4.60×10−5 55.04 1.8×10−5** 误差 2.00×10−6 2 2.03×10−7 总计 17.13 9 校准总和 3.69×10−4 8 注:*表示P<0.05,差异显著;**表示P<0.01,差异极显著。 2.3 GC-MS结果分析
对黄金茶挥发油进行GC-MS检测分析,共分离出23个峰,并采用面积归一化法计算黄金茶挥发油各组分相对含量,总离子流图见图4,黄金茶挥发油成分的GC-MS分析结果见表4。数据显示,有21种成分被鉴定出,鉴定出的物质成分占总峰的93.27%,黄金茶挥发油主要以萜类化合物为主,是该挥发油香气的主要成分。在鉴定出的化合物中,相对含量在1%以上的有15种,占被检测物质总量的88.75%,其中(1-甲基-4-丙-1-烯-2-基环己基)乙酸酯的含量达到50.67%,其次是α-蒎烯(6.92%)、α-乙酸松油酯(5.77%)、环氧化蛇麻烯II(3.96%)、伪柠檬烯(3.21%)、右旋大根香叶烯(3.12%)等。
表 4 黄金茶挥发油成分的GC-MS分析结果Table 4. GC-MS analysis of essential oil from Chimonanthus nitens Oliv序号 保留时间(min) 分子式 化学成分 相对含量(%) 1 8.099 C10H16 α-蒎烯(α-Pinene) 6.92 2 8.458 C10H16 樟脑萜(Camphene) 0.78 3 8.932 C10H16 香桧烯(Sabinene) 0.85 4 9.085 C10H16 β-蒎烯(β-Pinene) 2.90 5 10.209 C10H16 水芹烯(Phellandrene) 1.02 6 10.331 C10H14 邻伞花烃(o-Cymene) 2.06 7 10.459 C12H20O2 (1-甲基-4-丙-1-烯-2-基环己基)乙酸酯(Cyclohexanol, 1-methyl-4-(1-methylethenyl)-, acetate) 50.67 8 14.411 C10H18O 桉油精(Eucalyptol) 1.22 9 20.881 C10H16O 左旋樟脑((-)-Camphor-) 1.89 10 22.371 C12H20O2 醋酸冰片酯(Bornyl acetate) 1.27 11 23.836 C10H16 伪柠檬烯(Pseudolimonen) 3.21 12 26.892 C12H20O2 α-乙酸松油酯(α-Terpinyl acetate) 5.77 13 28.06 C15H24 β-榄香烯(β-Elemene) 1.60 14 28.869 C15H24 石竹烯(Caryophyllene) 1.12 15 29.717 C15H24 律草烯(Humulene) 0.67 16 29.902 C15H24 右旋大根香叶烯(Germacrene D) 3.12 17 31.301 C15H24 γ-榄香烯(γ-Elemene) 0.81 18 31.38 C15H24 γ-毕澄茄烯(γ-cadinene) 2.02 19 31.903 C15H24 δ-杜松烯(δ-Cadinene) 0.77 20 33.211 C15H24O 石竹素(Caryophyllene oxide) 0.64 21 41.531 C15H24O 环氧化蛇麻烯 II(Humulene epoxide II) 3.96 目前黄金茶挥发油组分的相关检测研究未见报道。徐年军等[10]报道了山腊梅叶中挥发油成分分析,与本实验获得的黄金茶挥发油的组分对比发现主要成分相似,但也有一定的差异,主要体现在成分(1-甲基-4-丙-1-烯-2-基环己基)乙酸酯的不同,黄金茶中该乙酸酯含量为50.67%。与山腊梅相比,黄金茶挥发油成分的差异因素,可能与黄金茶的制备或挥发油的提取过程有关:原材料山腊梅叶中醇类物质在热环境下氧化合成为酯类物质,但确切的因素需要实验进一步研究。
2.4 黄金茶挥发油抗氧化活性测定
2.4.1 黄金茶挥发油对DPPH自由基的清除作用
DPPH自由基的还原能力能使深紫色溶液被中变成无色或浅黄色,这可以作为评价抗氧化的方法[24-25]。结果表明,在各浓度梯度中黄金茶挥发油呈现出一定的剂量效应关系,如图5所示,其清除DPPH自由基能力随着浓度的升高而增大,黄金茶挥发油的IC50为81.60 mg/mL,当浓度达到100 mg/mL时,清除作用达到56.13%,而2,6-二叔丁基-4-甲基苯酚(BHT)的清除率达到95.42%,与BHT相比较,黄金茶挥发油对DPPH自由基的清除作用低于BHT的抗氧化作用。以上结果显示,黄金茶挥发油具有一定DPPH自由基的清除作用。
2.4.2 黄金茶挥发油对还原力的测定
实验结果如图6所示,黄金茶挥发油在10 mg/mL时与阳性对照组还原力最为接近,当浓度继续增大时,还原力处于缓慢上升的趋势,黄金茶挥发油浓度在40~50 mg/mL时还原力呈现快速上升趋势,但相比较于BHT,黄金茶挥发油对铁离子的还原能力较弱。以上结果表明黄金茶挥发油具有较强的还原力。
2.4.3 黄金茶挥发油对金属离子螯合能力的测定
如图7所示,黄金茶挥发油对金属离子螯合能力的IC50为17.16 mg/mL,且黄金茶挥发油对亚铁离子螯合能力随呈现剂量依赖性,当浓度达到40 mg/mL时,金属离子螯合能力达到81.06%,此时,EDTA的金属离子螯合能力达到93.94%,与EDTA相比,黄金茶挥发油的金属离子螯合能力较低。以上结果可知黄金茶挥发油具有的螯合亚铁离子能力。
3. 结论
通过单因素实验和正交试验确认微波辅助水蒸气蒸馏法提取黄金茶挥发油的最优工艺为微波时间10 min,料液比1:25 g/mL,水蒸气蒸馏时间5 h,此条件下黄金茶挥发油得率为1.7792%。通过GC-MS分析可知黄金茶挥发油中含有21种化学成分,其主要成分是为酯类化合物和萜类化合物。从抗氧化实验可以看出黄金茶挥发油对DPPH自由基清除能力、还原力和金属离子螯合能力都呈现出抗氧化作用。以上结论说明,黄金茶挥发油是一种具有抗氧化作用的有待开发的天然活性物质,但由于黄金茶挥发油的组成成分丰富,其抗氧化机理及清除自由基活性成分分析仍需进一步研究。
-
表 1 正交试验因素与水平设计
Table 1 Orthogonal experimental factors and levels
水平 因素 A微波时间(min) B料液比(g/mL) C水蒸气蒸馏时间(h) 1 5 1:25 4 2 10 1:30 5 3 15 1:35 6 表 2 正交试验结果与分析
Table 2 Results and analysis of orthogonal test
试验号 A微波时间(min) B料液比(g/mL) C水蒸气蒸馏时间(h) 挥发油得率(%) 1 1 1 1 1.2385 2 1 2 2 1.4191 3 1 3 3 1.1591 4 2 1 2 1.7409 5 2 2 3 1.5185 6 2 3 1 1.5637 7 3 1 3 1.0675 8 3 2 1 1.2484 9 3 3 2 1.3247 K1 3.82 4.05 4.05 K2 4.82 4.19 4.48 K3 3.64 4.05 3.75 k1 1.27 1.35 1.35 k2 1.61 1.40 1.49 k3 1.21 1.35 1.25 R 0.39 0.05 0.25 主次顺序 A>C>B 优水平 A2 B2 C2 优组合 A2B2C2 表 3 正交试验方差分析结果
Table 3 Tests of Between-Subjects effects
方差来源 偏差平方和 自由度 均方 F值 显著性 修正模型 3.68×10−3a 6 6.10×10−5 73.26 1.40×10−5 截距 16.76 1 16.76 20029.70 0.00 A 2.71×10−3 2 1.36×10−3 162.18 6.00×10−6** B 4.00×10−6 2 2.00×10−6 2.56 0.28 C 9.20×10−5 2 4.60×10−5 55.04 1.8×10−5** 误差 2.00×10−6 2 2.03×10−7 总计 17.13 9 校准总和 3.69×10−4 8 注:*表示P<0.05,差异显著;**表示P<0.01,差异极显著。 表 4 黄金茶挥发油成分的GC-MS分析结果
Table 4 GC-MS analysis of essential oil from Chimonanthus nitens Oliv
序号 保留时间(min) 分子式 化学成分 相对含量(%) 1 8.099 C10H16 α-蒎烯(α-Pinene) 6.92 2 8.458 C10H16 樟脑萜(Camphene) 0.78 3 8.932 C10H16 香桧烯(Sabinene) 0.85 4 9.085 C10H16 β-蒎烯(β-Pinene) 2.90 5 10.209 C10H16 水芹烯(Phellandrene) 1.02 6 10.331 C10H14 邻伞花烃(o-Cymene) 2.06 7 10.459 C12H20O2 (1-甲基-4-丙-1-烯-2-基环己基)乙酸酯(Cyclohexanol, 1-methyl-4-(1-methylethenyl)-, acetate) 50.67 8 14.411 C10H18O 桉油精(Eucalyptol) 1.22 9 20.881 C10H16O 左旋樟脑((-)-Camphor-) 1.89 10 22.371 C12H20O2 醋酸冰片酯(Bornyl acetate) 1.27 11 23.836 C10H16 伪柠檬烯(Pseudolimonen) 3.21 12 26.892 C12H20O2 α-乙酸松油酯(α-Terpinyl acetate) 5.77 13 28.06 C15H24 β-榄香烯(β-Elemene) 1.60 14 28.869 C15H24 石竹烯(Caryophyllene) 1.12 15 29.717 C15H24 律草烯(Humulene) 0.67 16 29.902 C15H24 右旋大根香叶烯(Germacrene D) 3.12 17 31.301 C15H24 γ-榄香烯(γ-Elemene) 0.81 18 31.38 C15H24 γ-毕澄茄烯(γ-cadinene) 2.02 19 31.903 C15H24 δ-杜松烯(δ-Cadinene) 0.77 20 33.211 C15H24O 石竹素(Caryophyllene oxide) 0.64 21 41.531 C15H24O 环氧化蛇麻烯 II(Humulene epoxide II) 3.96 -
[1] 陈慧. 黄金茶乙醇提取物的成分分析及降血糖作用研究[D]. 南昌: 江西农业大学, 2018. [2] Chen H, Ouyang K, Jiang Y, et al. Constituent analysis of the ethanol extracts of Chimonanthus nitens Oliv. leaves and their inhibitory effect on α-glucosidase activity[J]. International Journal of Biological Macromolecules,2017,98(5):829−836.
[3] 黄文平, 温芝琪, 王萌萌, 等. 山腊梅叶中8种成分含量测定及主成分分析[J]. 中药新药与临床药理,2018,29(6):799−803. [4] Zhang Q, Huo R, Ma Y, et al. A novel microwave-assisted steam distillation approach for separation of essential oil from tree peony (Paeonia suffruticosa Andrews) petals: Optimization, kinetic, chemical composition and antioxidant activity[J]. Industrial Crops & Products,2020:154.
[5] Pérez-Burillo S, Giménez R, Rufián-Henares J, et al. Effect of brewing time and temperature on antioxidant capacity and phenols of white tea: Relationship with sensory properties[J]. Food Chemistry,2018,248(15):111−118.
[6] 王治芬, 张妮, 马小攀, 等. 蜡梅不同部位精油化学成分分析及其体外抑菌活性研究[J]. 中国现代应用药学,2019,36(8):901−905. [7] 李正国, 刘明春, 邓伟, 等. 素心蜡梅和红心蜡梅鲜花挥发油成分分析[J]. 精细化工,2008,25(10):985−988, 992. doi: 10.3321/j.issn:1003-5214.2008.10.013 [8] 刘志雄, 刘祝祥. 超临界CO2萃取腊梅籽化学成分研究[J]. 中药材,2008,31(7):992−995. doi: 10.3321/j.issn:1001-4454.2008.07.017 [9] 陈静慧, 石浩, 张强, 等. 基于电子鼻和顶空固相微萃取-气相质谱联用技术分析柠檬草中的挥发性成分[J]. 食品与发酵工业,2019,45(3):231−236. [10] 徐年军, 白海波, 严小军, 等. 山腊梅中挥发油成分分析[J]. 分析测试学报,2006,25(1):90−93. doi: 10.3969/j.issn.1004-4957.2006.01.024 [11] 沈强. 腊梅花精油提取工艺及成分比较[D]. 重庆: 西南大学, 2009. [12] 万敏, 吴文英, 姚于飞, 等. 山腊梅精油提取工艺研究进展[J]. 药物流行病学杂志,2020,29(增刊):107−110. [13] 权春梅, 周光姣, 朱勇, 等. 精油提取方法及芍花精油的研究进展[J]. 广州化工,2016,44(20):16−17, 42. doi: 10.3969/j.issn.1001-9677.2016.20.006 [14] 梁晓媛, 李隆云, 白志川. 青蒿中青蒿素提取工艺研究进展[J]. 重庆理工大学学报(自然科学版),2013(2):32−38. [15] 谢明勇, 陈奕. 微波辅助萃取技术研究进展[J]. 食品与生物技术学报,2006,25(1):105−114. doi: 10.3321/j.issn:1673-1689.2006.01.022 [16] Kanwar J, Taskeen M, Mohammad I, et al. Kanwar Jyoti, Taskeen Mujtaba, Mohammad Imthiyaz, et al. Recent advances on tea polyphenols.[J]. Frontiers in bioscience (Elite edition),2012,4(4):111.
[17] 尹术华, 吴文英, 宋也好, 等. 白扁豆非淀粉多糖的理化性质、抗氧化活性及其抑菌性能[J]. 食品工业科技,2020,41(19):39-44. [18] Nuengchamnong N, Krittasilp K, Ingkaninan K. Characterisation of phenolic antioxidants in aqueous extract of Orthosiphon grandiflorus tea by LC-ESI-MS/MS coupled to DPPH assay[J]. Food chemistry,2011,127(3):1287−1293. doi: 10.1016/j.foodchem.2011.01.085
[19] Zhao C, Li X, Miao J, et al. The effect of different extraction techniques on property and bioactivity of polysaccharides from Dioscorea hemsleyi[J]. International Journal of Biological Macromolecules,2017,102(9):847−85.
[20] 吴杨洋, 周妍汝, 刘春燕, 等. 灵芝多糖提取工艺优化及抗氧化活性的研究[J]. 食品安全质量检测学报,2020,11(14):4636−4642. [21] 刘琼, 夏道宗, 叶晓萍, 等. 安吉白茶含片的制作及其抗氧化活性评价[J]. 食品工业科技,2012,33(18):245−247, 252. [22] 王亚丽, 赵文霞, 魏娟娟, 等. 微波辅助水蒸气蒸馏法提取迷迭香精油[J]. 宁夏师范学院学报,2019,40(7):43−48. doi: 10.3969/j.issn.1674-1331.2019.07.007 [23] 李安, 刘印, 张泽望, 等. 微波辅助提取艾纳香精油的工艺优化及抗菌活性的研究[J]. 福建农业学报,2017,32(7):751−755. [24] Chen X, Liang L, Han C. Borate suppresses the scavenging activity of gallic acid and plant polyphenol extracts on DPPH radical: A potential interference to DPPH assay[J]. LWT-Food Science and Technology,2020,131(9):1−7.
[25] Bao Y, Ren X, Zhu Y, et al. Comparison of lipid radical scavenging capacity of spice extract in situ in roast beef with DPPH and peroxy radical scavenging capacities in vitro models[J]. LWT, 2020(prepublish). https://doi.org/10.1016/j.lwt.2020.109626.





 下载:
下载:
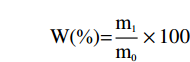
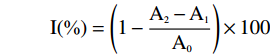
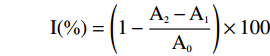







 下载:
下载:
