Determination of Zeaxanthin Dipalmitate and 2-O-(β-D-glucopyranosyl) Ascorbic Acid in Fruit of Lycium barbarum L.
-
摘要: 目的:建立枸杞子中脂溶性活性成分玉米黄素双棕榈酸酯及水溶性活性成分枸杞酸(AA2βG,即2-O-(β-葡糖苷)-抗坏血酸)的液相含量测定方法。方法:采用高效液相色谱法,色谱条件为Luna C18(2)色谱柱(4.6 mm×250 mm,5 μm),流动相丙酮: 甲醇=55:45,等度洗脱,流速1.0 mL/min,柱温25 ℃,检测波长450 nm;枸杞酸检测:UPLC,Waters二醇基柱Torus TM Diol Column(3 mm×100 mm,1.7 μm),流动相为乙腈−66.7 mmol/L醋酸铵(体积比85:15),等度洗脱,流速为0.4 mL/min,柱温40 ℃,检测波长260 nm。结果:玉米黄素双棕榈酸酯在0.01~0.1 mg/mL范围内线性关系良好,r为0.9990;平均回收率为99.44%,RSD为4.04%。枸杞酸在3.125~100 μg/mL范围内线性关系良好,r为1.0000;平均回收率为96.30%,RSD为3.61%。22批枸杞样品中,玉米黄素双棕榈酸酯含量最高可达0.51%,枸杞酸含量最高可达1.33%。结论:该方法均准确可靠,重现性良好,可用于枸杞子的质量控制。
-
关键词:
- 枸杞子 /
- 玉米黄素双棕榈酸酯 /
- 枸杞酸 /
- 高效液相色谱法(HPLC) /
- 超高效液相色谱法(UPLC)
Abstract: Objective: To establish LC methods for zeaxanthin dipalmitate and 2-O-(β-D-glucopyranosyl) ascorbic acid determination in the fruit of Lycium barbarum L. Methods: For the HPLC analysis of zeaxanthin dipalmitate, the test was performed on a Luna C18 (2) column (4.6 mm×250 mm, 5 μm) with the column temperature at 25 ℃. The isocratic elution was adopted with the mobile phase of acetone/MeOH 55:45(V/V) at a flow rate of 1.0 mL·min−1, and UV detection was performed at 450 nm. UPLC analysis of ascorbic acid was carried out on Torus TM Diol Column (3 mm×100 mm, 1.7 μm) at the temperature of 40 ℃. An isocratic system was also used at which the mobile phase (flow rate of 0.4 mL/min) consisting of acetonitrile (solventA) and 66.7 mmol/L ammonium acetate (solvent B) was set as 85% A and 15% B. UV detection wavelength was set at 260 nm. Results: The linear range of zeaxanthin dipalmitate and 2-O-(β-D-glucopyranosyl) ascorbic acid were 0.01~0.1 mg/mL and 3.125~100 μg/mL, with the correlation coefficient being 0.9990 and 1.0000, the average recovery was 99.44% and 96.30%, while the RSD was 4.04% and 3.61% respectively. In 22 batches of L. barbarum samples, the contents of zeaxanthin dipalmitate and 2-O-(β-D-glucopyranosyl) ascorbic acid were up to 0.51% and 1.33%, respectively. Conclusion: The two methods were accurate and reliable, which could be used to control the quality of L.barbarum fruit.-
Keywords:
- Lycium barbarum L. /
- zeaxanthin dipalmitate /
- 2-O-(β-D-glucopyranosyl) ascorbic acid /
- HPLC /
- UPLC
-
枸杞子为茄科植物宁夏枸杞(Lycium barbarum L.)的干燥成熟果实,主要分布在我国西北的青海、宁夏、甘肃和新疆等地。枸杞子是我国传统药材,具有滋补肝肾,益精明目的作用[1]。现代药理研究证实其具有调节免疫、保肝[2-3]、抗氧化损伤[4]、保护视力[5]等作用。枸杞子中的化学成分分为脂溶性和水溶性成分。脂溶性成分主要是类胡萝卜素类等[6-7],又以玉米黄素双棕榈酸酯(C72H116O4,ZDP)为主以及少量玉米黄素[8-9]等。ZDP在体内代谢转化成玉米黄素[10-11],是预防黄斑病变和保护肝脏的主要成分[12-14]。枸杞子中的水溶性成分主要是2-O-β-D-葡萄糖基-L-抗坏血酸(C12H18O11,枸杞酸,AA2βG)、甜菜碱[15]和枸杞多糖[16]等物质。其中枸杞酸是天然的维生素C前体物质[17-18],具有美白、抗氧化、抗衰老、保肝等功效[19-21]。
枸杞子原料的产地来源多,质量也存在较大差异。目前,市场上枸杞声称以枸杞多糖为主要成分,且药典中以多糖和甜菜碱作为指标。然而,一方面枸杞中多糖检测繁琐,专属性不强,误差大;另一方面,甜菜碱的合成价格便宜,且甜菜根中含有大量甜菜碱[22-23],专属性较差,不能很好的用于枸杞子品质评价。ZDP和枸杞酸在枸杞子中含量丰富,且枸杞酸仅存在枸杞子中[24-25]。两种成分的含量均随着枸杞子成熟度升高而增高,其含量高低也是枸杞子品质的最直接反映[26-27]。已有文献报道过ZDP检测方法[28],前处理步骤多,易产生系统误差,且流动相体系复杂。枸杞酸已用于枸杞子提取物的品质评价[16],但未应用于枸杞子原药材的研究。
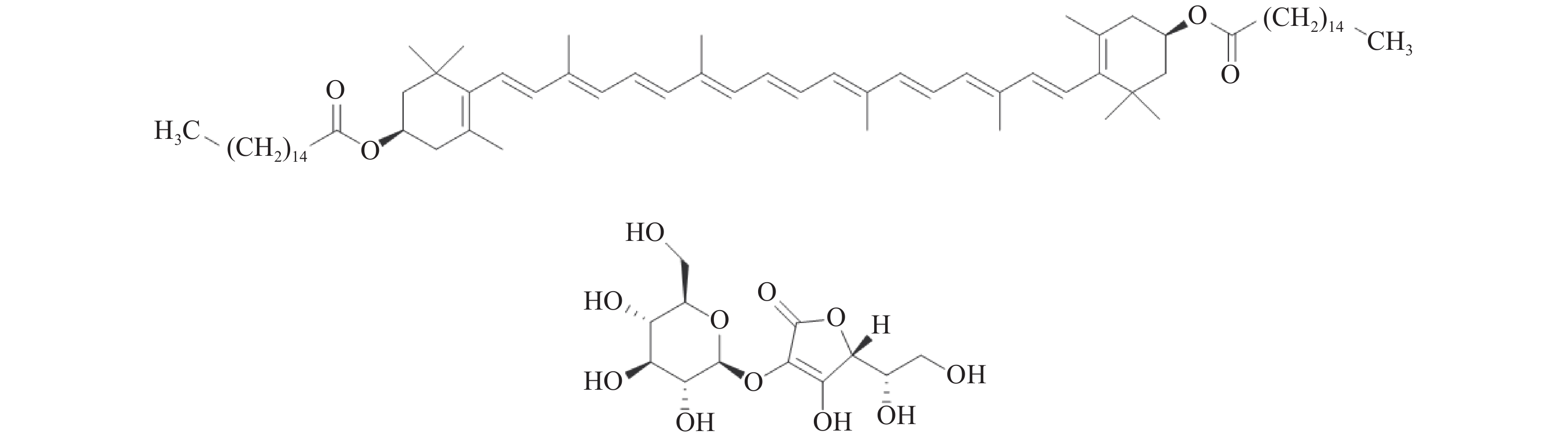
由于ZDP和枸杞酸的极性相差太大,暂不适合一起制备和分析(结构图见图1)[29]。针对ZDP成分,本文采用先去除枸杞子水溶性成分再提取ZDP的方法,减少转移次数,且流动相仅为丙酮及甲醇,前处理和液相条件均相对简单。另外,本文采用UPLC检测枸杞原料中枸杞酸的含量,分析速度快,分离度好,可在很大程度上缩短实验时间,提高实验效率。本实验以ZDP和枸杞酸作为枸杞子药材的指标成分进行品质评价,既兼顾脂溶性和水溶性成分,又体现了活性和特征性成分,还能有效检测枸杞子药材染色、掺假等情况,为日后提高枸杞子及其制剂的质量标准提供参考。
1. 材料与方法
1.1 材料与仪器
枸杞子 共22批,分别采自宁夏、甘肃、青海,具体信息见表1,经上海安利研发中心中药学专业陈亮博士鉴定为茄科植物宁夏枸杞(Lycium barbarum L.)的干燥成熟果实;正己烷、乙腈、甲醇 色谱级,美国Fisher公司;丙酮 AR级别,Greagent公司;对照品枸杞酸(批号8030,CAS号562043-82-7) 上海诗丹德标准技术服务有限公司;玉米黄素双棕榈酸酯(批号12) 上海甄选生物;醋酸铵 分析纯,上海泰坦科技有限公司。
表 1 22批枸杞子信息Table 1. Information of 22 batches of Lycium barbarum枸杞样品 产地 批号 S1 宁夏 20180901 S2 宁夏 20180902 S3 宁夏 20180903 S4 宁夏 20180904 S5 宁夏 20180905 S6 宁夏 20180906 S7 青海 20180907 S8 青海 20180908 S9 甘肃 20180909 S10 宁夏 20190901 S11 青海 20190902 S12 青海 20190903 S13 青海 20190904 S14 青海 20190905 S15 青海 20190906 S16 青海 20190907 S17 青海 20190908 S18 甘肃 20190908 S19 甘肃 20190909 S20 青海 20190910 S21 宁夏 20200801 S22 青海 20200802 超纯水系统 上海技舟化工科技有限公司;WF-600EHT型超声波清洗机 宁波海曙五方超声设备有限公司;XS2051/10万分之一电子天平、MS3002S型电子分析天平 梅特勒-托利多国际贸易有限公司;高效液相色谱仪HPLC(配PDA检测器)、超高效液相色谱仪UPLC(配PDA检测器) 美国Waters公司。
1.2 实验方法
1.2.1 溶液制备
1.2.1.1 对照品溶液的制备
精密称取ZDP标准品5 mg,加正己烷-丙酮(1:1)混合溶剂制成5 mg/mL对照品储备液。精密称取枸杞酸对照品5 mg左右,用水溶解,制成5 mg/mL枸杞酸对照品储备液。
1.2.1.2 供试品溶液的制备
ZDP提取方法参考文献[29]并进行调整。将枸杞子放在液氮中迅速冷冻后打粉,取枸杞子粉末(过40目筛)约500.000 mg,精密称定,加蒸馏水50 mL,超声处理20 min。样品溶液高速离心后弃去上清液。残渣中加正己烷-丙酮(1:1)混合溶剂20 mL,超声处理5次至残渣无色,每次20 min,过滤,合并滤液,用正己烷-丙酮混合溶剂定容至100 mL,摇匀,0.45 μm滤膜过滤,即得枸杞子提取液。注意提取过程在避光条件下进行。
枸杞酸提取方法参考文献[19]并进行调整。将枸杞子在液氮中迅速冷冻后打粉,取枸杞子粉末(过40目筛)约500.000 mg,精密称定,置具塞锥形瓶中,精密加入蒸馏水25 mL,称定重量,超声处理40 min,放冷至室温,用蒸馏水补足减失重量,摇匀。取清液1 mL至25 mL容量瓶中,用流动相定容,0.45 μm滤膜过滤,即得枸杞酸提取液。
1.2.2 色谱条件
ZDP检测:Luna C18(2)色谱柱(250 mm×4.6 mm,5 μm),流动相丙酮:甲醇=55:45,等度洗脱,流速1 mL/min,柱温25 ℃,检测波长450 nm,进样量10 μL。
枸杞酸检测:Waters二醇基柱Torus TM Diol Column(100 mm×3 mm,1.7 μm);进样量2 μL;流动相为乙腈−66.7 mmol/L醋酸铵(体积比85:15),等度洗脱,流速为0.4 mL/min,柱温40 ℃,检测波长260 nm。
1.2.3 含量计算
1.2.3.1 标准曲线的制作
用正己烷-丙酮(1:1)混合溶剂稀释“1.2.1.1”项下ZDP的对照品储备液,分别配制成10、20、40、60、80、100 μg/mL的ZDP对照品溶液,依次精密吸取对照品溶液10 μL注入液相色谱仪,按照“1.2.2”项下ZDP色谱条件下进行测定。以峰面积为纵坐标(Y),质量浓度为横坐标(X)拟合,得到线性回归方程和相关系数。
用流动相乙腈-66.7 mmol/L醋酸铵溶液(体积比85:15)稀释“1.2.1.1”项下枸杞酸对照品储备液,分别配制成3.125、6.25、12.5、25、50、100 μg/mL的枸杞酸对照品溶液,依次精密吸取对照品溶液2 μL注入液相色谱仪,按照“1.2.2”项下枸杞酸色谱条件进行测定。以峰面积为纵坐标(Y),质量浓度为横坐标(X)拟合,得到线性回归方程和相关系数。
1.2.3.2 结果计算
试样中ZDP、枸杞酸的含量按下式计算:
式中:X-试样中ZDP和枸杞酸的含量,%;c-根据标准曲线计算得到的试样中ZDP和枸杞酸的浓度,μg/mL;D-稀释倍数;V-定容液的体积,mL;m-试样的称样量,mg。
1.2.4 方法学考察实验
通过线性度、精密度、稳定性、重复性、加标回收率等考察方法的可行性。
1.3 数据处理
数据采集和分析软件分别为Waters e2695自带的Empower 3FR3和Excel 2016。
2. 结果与分析
2.1 线性关系
将ZDP和枸杞酸的标准工作溶液,各自按照实验色谱条件依次进样,根据浓度与峰面积的关系绘制标准曲线。ZDP的线性方程为y=4×107x+1646.9,r=0.9990。表明ZDP在质量浓度10~100 μg/mL范围内线性良好。枸杞酸的线性方程为y=11264x−1005,r=1.0000。表明枸杞酸当质量浓度为3.125~100 μg/mL范围内时线性良好。
2.2 精密度实验
由于丙酮溶剂挥发性极强,取ZDP对照品溶液分装到6个液相小瓶中,精密吸取对照品溶液10 μL注入液相色谱仪,连续进样6次,记录ZDP的峰面积;精密吸取枸杞酸对照品溶液2 μL注入液相色谱仪,重复进样6次,记录枸杞酸的峰面积,结果如表2。两者的RSD分别为0.85%、0.83%,表明仪器精密度良好。
表 2 玉米黄素双棕榈酸酯对照品及枸杞酸对照品精密度试验结果(n=6)Table 2. Precision test results of zeaxanthin dipalmitate and ascorbic acid (n =6)试验次数 玉米黄素双棕榈
酸酯峰面积RSD(%) 枸杞酸峰面积 RSD(%) 1 2256582 0.85 279050 0.83 2 2259713 285470 3 2232399 280629 4 2254195 282043 5 2242317 279947 6 2209334 283104 2.3 稳定性试验
取同一ZDP供试品溶液,分装在6个液相小瓶中,分别于0、2、4、8、12、24、48、72 h精密吸取供试品溶液10 μL注入液相色谱仪,记录ZDP的峰面积,0~24 h内ZDP峰面积RSD为1.06%,结果表明样品在24 h内稳定。ZDP在48 h后开始出现小范围的降解,72 h后降解程度达6.92%。因此,ZDP供试品前处理结束后宜在24 h内尽快检测。
取同一枸杞酸供试品溶液,分别于0、2、4、8、12、24、48、72 h精密吸取2 μL注入液相色谱仪,记录枸杞酸的峰面积,0~72 h内枸杞酸峰面积RSD为1.956%,表明样品在72 h内稳定(见表3)。
表 3 ZDP供试样品及枸杞酸供试样品稳定性试验结果Table 3. Stability test results of ZDP and ascorbic acid试验次数 时间(h) 玉米黄素双棕榈
酸酯峰面积RSD(%) 枸杞酸峰面积 RSD(%) 1 0 982923 1.06 120489 1.96 2 2 1003845 116359 3 4 988951 120696 4 8 992124 116419 5 12 1005349 115853 6 24 979983 115208 7 48 962793 115643 8 72 923491 114923 2.4 重复性试验
取同一批次枸杞子粉末(批号:20190908)6份,按照“1.2.1.2”项下制备供试品溶液依法测定,结果见表计算ZDP含量的RSD为1.88%,表明该方法的重复性良好。结果如表3。
取同一批次枸杞子粉末(批号:20190908)6份,按照“1.2.1.2”项下制备供试品溶液,依法测定,计算枸杞酸含量的RSD为1.82%,表明方法的重复性良好(见表4)。
表 4 供试样品中ZDP含量及枸杞酸含量的重复性试验结果Table 4. Repeatability test results of ZDP and ascorbic acid content试验次数 样品质量(mg) 样品中ZDP质量(mg) ZDP含量(%) RSD(%) 样品质量(mg) 样品中枸杞酸质量(mg) 枸杞酸含量(%) RSD(%) 1 500.232 2.45 0.49 1.88 500.478 6.69 1.34 1.82 2 500.187 2.49 0.50 500.823 6.68 1.33 3 500.804 2.44 0.49 500.253 6.71 1.34 4 499.775 2.38 0.48 500.246 6.40 1.28 5 500.212 2.49 0.50 500.380 6.55 1.31 6 500.578 2.50 0.50 499.411 6.51 1.30 2.5 加样回收率试验
精密称取ZDP含量已知的枸杞子粉末样品(批号:20190908),共9份,加入适量的ZDP对照品,按照“1.2.1.2”项下制备供试品溶液,依法测定,并计算回收率,结果如表5。RSD小于5%,表明ZDP检测方法有良好的回收率。
表 5 玉米黄素双棕榈酸酯加样回收试验结果Table 5. Results of recovery tests for ZDP成分 取样量(mg) 样品中含量(mg) 加入量(mg) 测得量(mg) 回收率(%) 平均回收率(%) RSD(%) 玉米黄素双棕榈酸酯 249.841 1.23 1.00 2.15 92.48 99.43 4.04 250.228 1.23 1.00 2.19 96.36 249.763 1.23 1.00 2.19 96.32 250.031 1.23 1.25 2.45 97.68 250.955 1.23 1.25 2.51 102.51 249.693 1.23 1.25 2.50 101.65 250.684 1.23 1.50 2.73 99.65 250.085 1.23 1.50 2.79 104.31 249.876 1.23 1.50 2.79 103.95 精密称取已知枸杞酸含量的枸杞子粉末样品(批号:20190908),共9份,分别添加适量的枸杞酸对照品,按照“1.2.1.2”项下制备供试品溶液,依法测定,计算回收率,结果如表6。RSD小于5%,表明枸杞酸检测方法有良好的回收率。
表 6 枸杞酸加样回收试验结果Table 6. Results of recovery tests for ascorbic acid成分 取样量(mg) 样品中含量(mg) 加入量(mg) 测得量(mg) 回收率(%) 平均回收率(%) RSD(%) 枸杞酸 250.873 3.23 1.50 4.71 98.81 96.30 3.61 250.891 3.23 1.50 4.68 96.57 250.721 3.23 1.50 4.73 99.96 250.365 3.22 3.00 6.10 95.95 249.530 3.21 3.00 6.24 100.74 249.928 3.22 3.00 5.97 91.69 250.512 3.23 4.50 7.54 95.78 249.709 3.22 4.50 7.28 90.34 250.414 3.23 4.50 7.58 96.84 2.6 样品测定
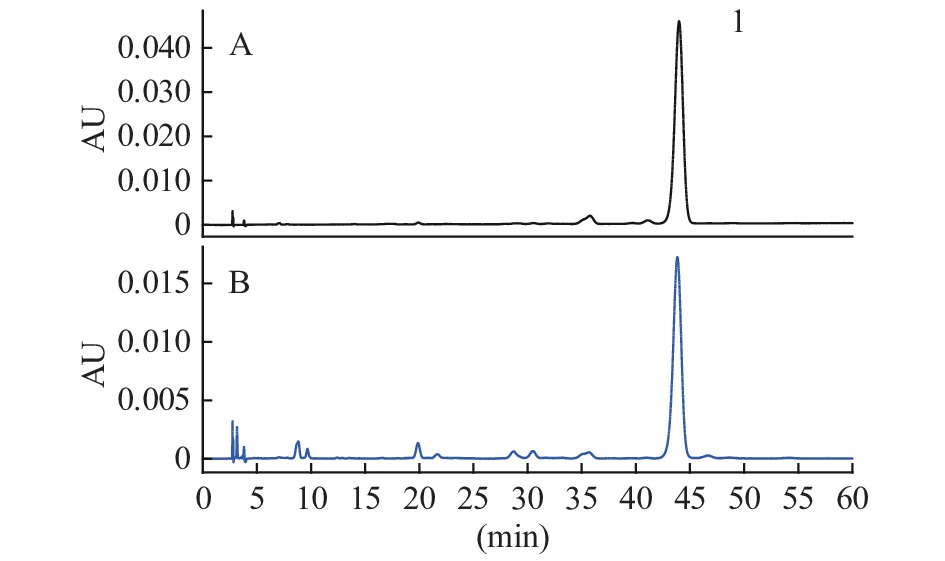
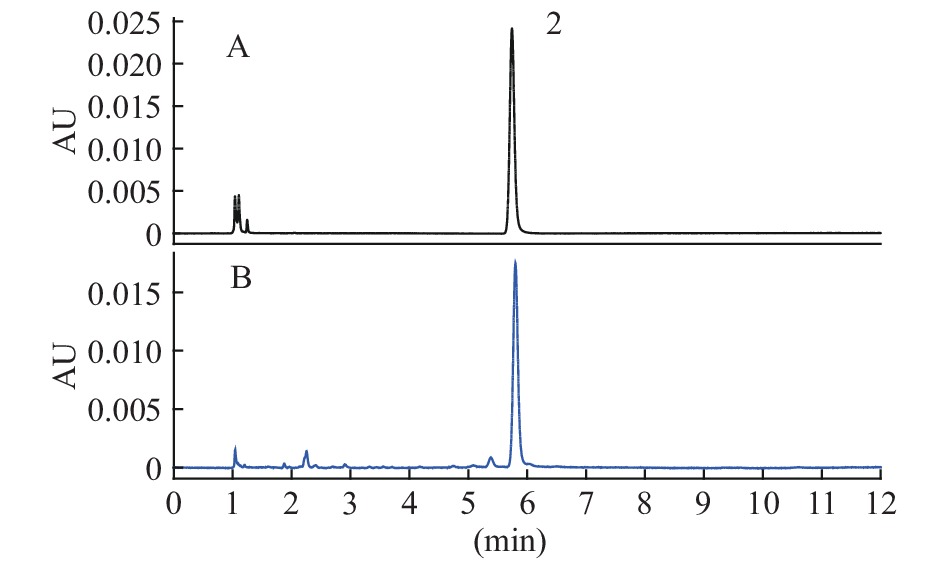
按建立的方法,对22批枸杞子样品进行ZDP及枸杞酸含量的测定,结果见表7。ZDP对照品及ZDP供试品溶液高效液相色谱图谱见图2。枸杞酸对照品及枸杞酸供试品溶液超高效液相色谱图见图3。
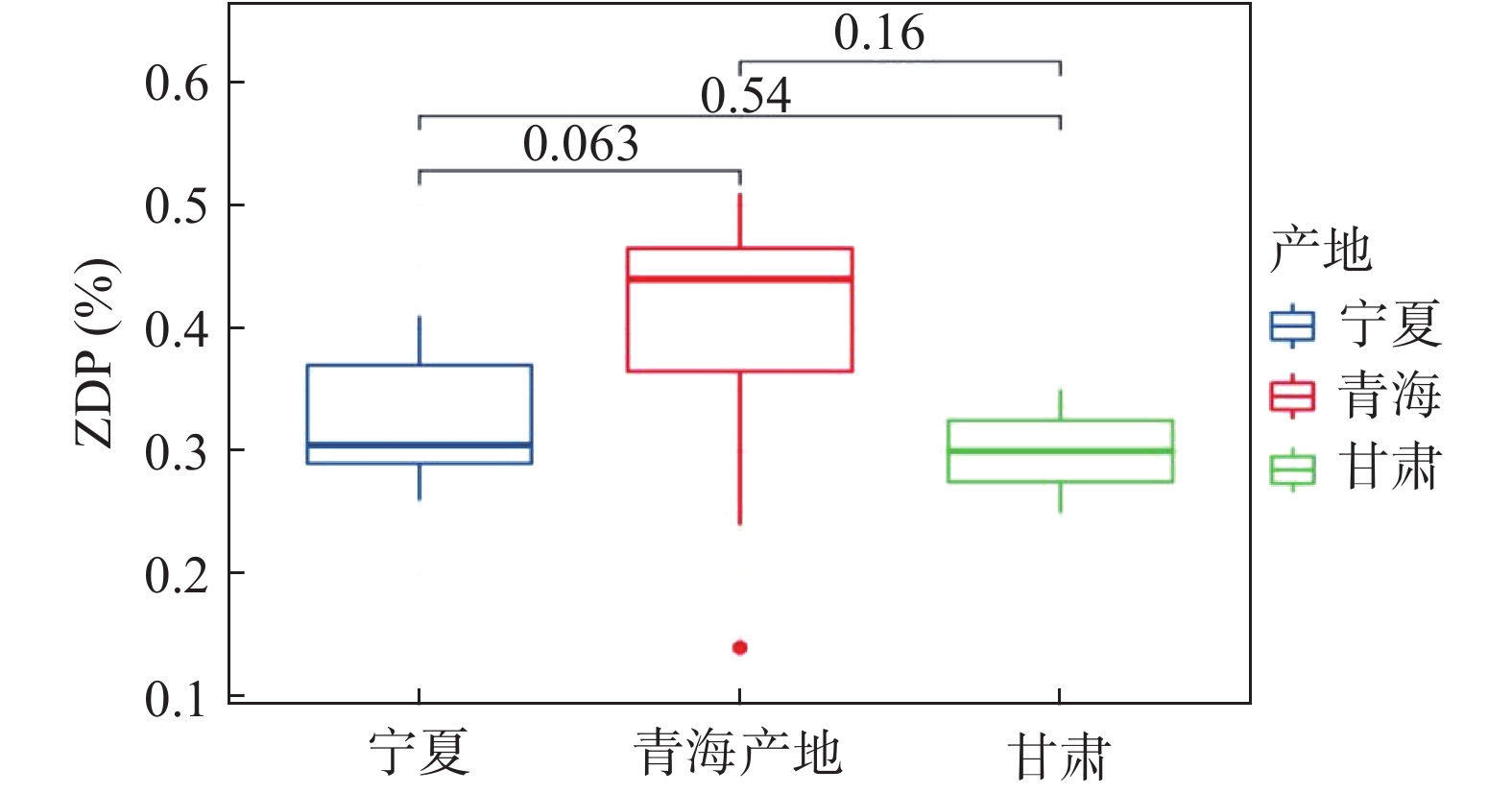
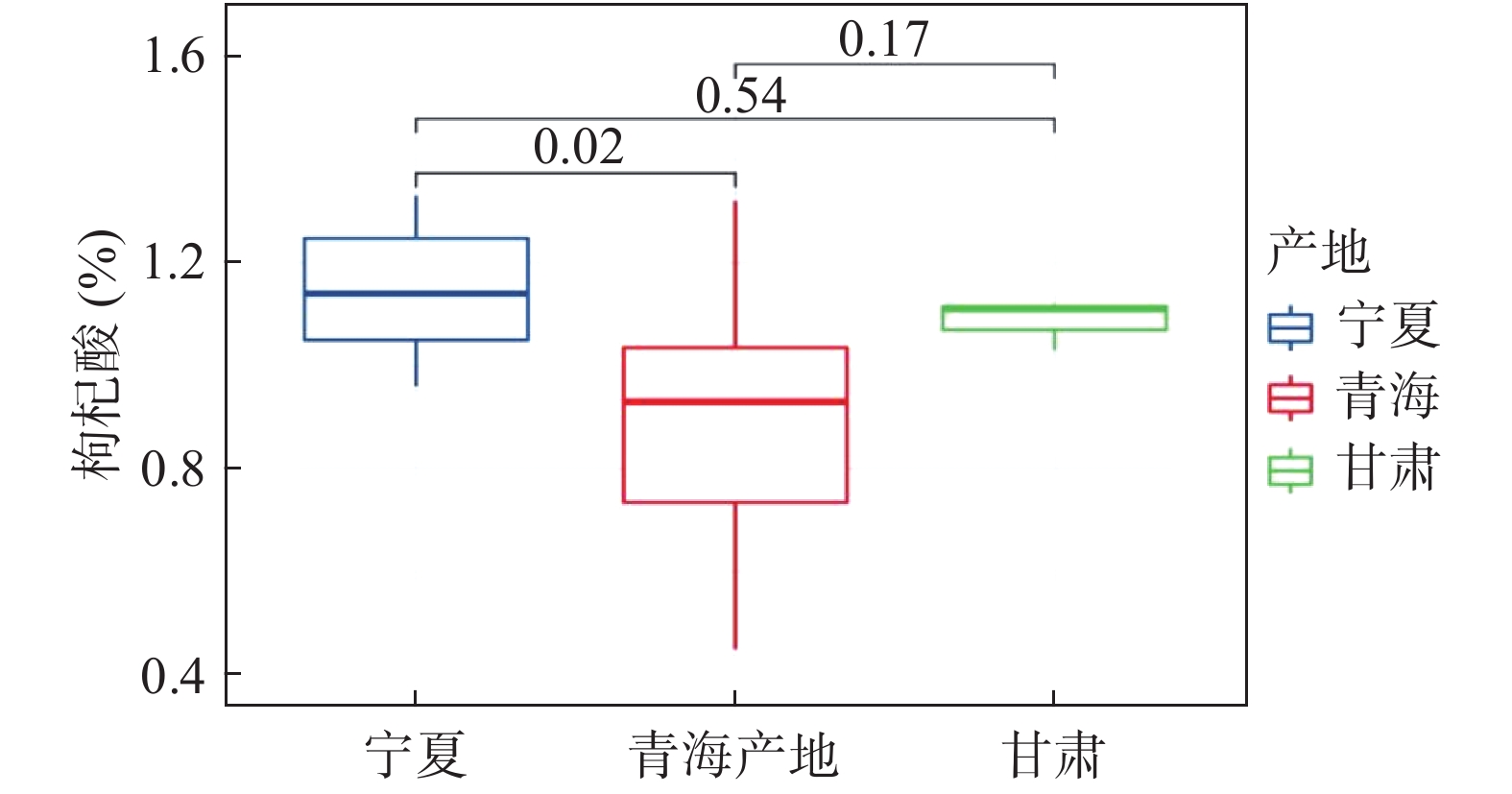
表 7 枸杞中玉米黄素双棕榈酸酯及枸杞酸的含量测定结果Table 7. Results of content assay for ZDP and ascorbic acid in fruits of Lycium barbarum L.枸杞样品 ZDP含量(%) 枸杞酸含量(%) S1 0.26 1.33 S2 0.30 1.16 S3 0.31 1.12 S4 0.29 1.02 S5 0.36 1.06 S6 0.29 0.96 S7 0.24 0.69 S8 0.39 1.00 S9 0.25 1.12 S10 0.41 1.24 S11 0.44 0.93 S12 0.51 1.07 S13 0.46 0.45 S14 0.47 0.60 S15 0.44 0.98 S16 0.34 0.92 S17 0.49 1.32 S18 0.35 1.03 S19 0.30 1.11 S20 0.14 0.78 S21 0.40 1.27 S22 0.43 1.14 本文对不同产地不同年份的22批次枸杞子样品进行分析,结果显示,ZDP与枸杞酸稳定存在各批次样品中,ZDP含量在0.14%~0.51%之间,枸杞酸含量在0.45%~1.33%之间。不同地区枸杞子中的ZDP并没有明显的差异性(见图4)。宁夏枸杞子中的枸杞酸相比较青海枸杞子含量更高,且存在显著性差异(P<0.05),但与甘肃枸杞子并无显著性差异(见图5)。
3. 讨论与结论
本研究分别采用HPLC及UPLC检测枸杞子脂溶性活性成分ZDP及水溶性活性成分枸杞酸含量。ZDP极性小且对光热较为敏感,所以用“正己烷-丙酮”提取,实验全程低温避光稳定性实验中发现ZDP在48 h后开始出现小范围的降解,72 h后降解明显。因此,ZDP供试品前处理结束后宜在24 h内尽快检测。本文的检测结果与白光灿[26]的结果相差近10倍,但与陈敏等[28]报道结果接近。枸杞酸极性大且稳定性非常好,所以用水超声提取。平行测定6次,ZDP及枸杞酸的相对标准偏差(RSD)分别为1.88%、1.82%,加样回收率分别在92.48%~104.31%,90.345%~100.743%。表明2种方法均重现性良好、准确可行。
本文对不同产地不同年份的22批次枸杞子样品进行分析,结果显示,ZDP与枸杞酸稳定存在各批次样品中,ZDP含量在0.14%~0.51%之间,枸杞酸含量在0.45%~1.33%之间。该方法操作简单,检测结果能够较好地反映枸杞子的品质,为枸杞子样品的品质评价提供参考。
尽管本文对ZDP的方法进行了改进,但提取及液相分析时间仍然很长。后期可进一步简化提取步骤,并采用超合相色谱进行分析。超合相色谱在分析极强的亲脂性化合物时可得到与反相LC类似的保留特征,且流动相换为超临界或亚临界状态的压缩CO2,减少正相流动相中有害溶剂的使用。
-
表 1 22批枸杞子信息
Table 1 Information of 22 batches of Lycium barbarum
枸杞样品 产地 批号 S1 宁夏 20180901 S2 宁夏 20180902 S3 宁夏 20180903 S4 宁夏 20180904 S5 宁夏 20180905 S6 宁夏 20180906 S7 青海 20180907 S8 青海 20180908 S9 甘肃 20180909 S10 宁夏 20190901 S11 青海 20190902 S12 青海 20190903 S13 青海 20190904 S14 青海 20190905 S15 青海 20190906 S16 青海 20190907 S17 青海 20190908 S18 甘肃 20190908 S19 甘肃 20190909 S20 青海 20190910 S21 宁夏 20200801 S22 青海 20200802 表 2 玉米黄素双棕榈酸酯对照品及枸杞酸对照品精密度试验结果(n=6)
Table 2 Precision test results of zeaxanthin dipalmitate and ascorbic acid (n =6)
试验次数 玉米黄素双棕榈
酸酯峰面积RSD(%) 枸杞酸峰面积 RSD(%) 1 2256582 0.85 279050 0.83 2 2259713 285470 3 2232399 280629 4 2254195 282043 5 2242317 279947 6 2209334 283104 表 3 ZDP供试样品及枸杞酸供试样品稳定性试验结果
Table 3 Stability test results of ZDP and ascorbic acid
试验次数 时间(h) 玉米黄素双棕榈
酸酯峰面积RSD(%) 枸杞酸峰面积 RSD(%) 1 0 982923 1.06 120489 1.96 2 2 1003845 116359 3 4 988951 120696 4 8 992124 116419 5 12 1005349 115853 6 24 979983 115208 7 48 962793 115643 8 72 923491 114923 表 4 供试样品中ZDP含量及枸杞酸含量的重复性试验结果
Table 4 Repeatability test results of ZDP and ascorbic acid content
试验次数 样品质量(mg) 样品中ZDP质量(mg) ZDP含量(%) RSD(%) 样品质量(mg) 样品中枸杞酸质量(mg) 枸杞酸含量(%) RSD(%) 1 500.232 2.45 0.49 1.88 500.478 6.69 1.34 1.82 2 500.187 2.49 0.50 500.823 6.68 1.33 3 500.804 2.44 0.49 500.253 6.71 1.34 4 499.775 2.38 0.48 500.246 6.40 1.28 5 500.212 2.49 0.50 500.380 6.55 1.31 6 500.578 2.50 0.50 499.411 6.51 1.30 表 5 玉米黄素双棕榈酸酯加样回收试验结果
Table 5 Results of recovery tests for ZDP
成分 取样量(mg) 样品中含量(mg) 加入量(mg) 测得量(mg) 回收率(%) 平均回收率(%) RSD(%) 玉米黄素双棕榈酸酯 249.841 1.23 1.00 2.15 92.48 99.43 4.04 250.228 1.23 1.00 2.19 96.36 249.763 1.23 1.00 2.19 96.32 250.031 1.23 1.25 2.45 97.68 250.955 1.23 1.25 2.51 102.51 249.693 1.23 1.25 2.50 101.65 250.684 1.23 1.50 2.73 99.65 250.085 1.23 1.50 2.79 104.31 249.876 1.23 1.50 2.79 103.95 表 6 枸杞酸加样回收试验结果
Table 6 Results of recovery tests for ascorbic acid
成分 取样量(mg) 样品中含量(mg) 加入量(mg) 测得量(mg) 回收率(%) 平均回收率(%) RSD(%) 枸杞酸 250.873 3.23 1.50 4.71 98.81 96.30 3.61 250.891 3.23 1.50 4.68 96.57 250.721 3.23 1.50 4.73 99.96 250.365 3.22 3.00 6.10 95.95 249.530 3.21 3.00 6.24 100.74 249.928 3.22 3.00 5.97 91.69 250.512 3.23 4.50 7.54 95.78 249.709 3.22 4.50 7.28 90.34 250.414 3.23 4.50 7.58 96.84 表 7 枸杞中玉米黄素双棕榈酸酯及枸杞酸的含量测定结果
Table 7 Results of content assay for ZDP and ascorbic acid in fruits of Lycium barbarum L.
枸杞样品 ZDP含量(%) 枸杞酸含量(%) S1 0.26 1.33 S2 0.30 1.16 S3 0.31 1.12 S4 0.29 1.02 S5 0.36 1.06 S6 0.29 0.96 S7 0.24 0.69 S8 0.39 1.00 S9 0.25 1.12 S10 0.41 1.24 S11 0.44 0.93 S12 0.51 1.07 S13 0.46 0.45 S14 0.47 0.60 S15 0.44 0.98 S16 0.34 0.92 S17 0.49 1.32 S18 0.35 1.03 S19 0.30 1.11 S20 0.14 0.78 S21 0.40 1.27 S22 0.43 1.14 -
[1] 王燕平. 中国药典[J]. China Standardization, 2020. [2] Xiao J, Wang J, Xing F, et al. Zeaxanthin dipalmitate therapeutically improves hepatic functions in an alcoholic fatty liver disease model through modulating MAPK pathway[J]. PLoS One,2014,9:e95214. doi: 10.1371/journal.pone.0095214
[3] Kim H P, Lee E J, Kim Y C, et al. Zeaxanthin dipalmitate from Lycium chinense fruit reduces experimentally induced hepatic fibrosis in rats[J]. Biol Pharm Bull,2002,25:390−392. doi: 10.1248/bpb.25.390
[4] Johnson E J. Role of lutein and zeaxanthin in visual and cognitive function throughout the lifespan[J]. Nutr Rev,2014,72:605−612. doi: 10.1111/nure.12133
[5] Milani A, Basirnejad M, Shahbazi S, et al. Carotenoids: biochemistry, pharmacology and treatment[J]. British Journal of Pharmacology,2017,174(11):1290−1324. doi: 10.1111/bph.13625
[6] Liu Y, Zeng S, Sun W, et al. Comparative analysis of carotenoid accumulation in two goji (Lycium barbarum L. and L. ruthenicum Murr.) fruits[J]. BMC Plant Biology,2014,14 (1):269. doi: 10.1186/s12870-014-0269-4
[7] 肖佳, 高昊, 周正群, 等. 枸杞属中枸杞红素类成分研究进展[J]. 科学通报,2017,62(16):1691−1698. [8] 白光灿, 李娅琦, 张泽坤, 等. 枸杞HPLC指纹图谱的建立及3种成分测定[J]. 中成药,2019,41(7):1721−1724. [9] Weller P, Breithaupt D E. Identification and quantification of zeaxanthin esters in plants using liquid chromatography-mass spectrometry[J]. Journal of Agricultural & Food Chemistry,2003,51(24):7044−7049.
[10] Leung I, Tso M, Li W, et al. Absorption and tissue distribution of zeaxanthin and lutein in rhesus monkeys after taking Fructus lycii (Gou Qi Zi) extract[J]. Invest Ophthalmology & Visual Science,2001,42(2):466−471.
[11] Breithaupt D E, Weller P, Wolters M, et al. Comparison of plasma responses in human subjects after the ingestion of 3R, 3R′-zeaxanthin dipalmitate from wolfberry (Lycium barbarum) and non-esterified 3R, 3R′-zeaxanthin using chiral high-performance liquid chromatography[J]. British journal of nutrition,2004,91(5):707−713. doi: 10.1079/BJN20041105
[12] Scripsema N K, Hu D N, Rosen R B. Lutein, zeaxanthin, and meso-zeaxanthin in the clinical management of eye disease[J]. Journal of Ophthalmology,2015,2015:865179. doi: 10.1155/2015/865179
[13] Firdous A P, Sindhu E R, Kuttan R. Hepato-protective potential of carotenoid meso-zeaxanthin against paracetamol, CCl4 and ethanol induced toxicity[J]. Indian J Exp Biol,2011,49:44−49.
[14] 李静静. 枸杞红素在慢性乙肝合并非酒精性脂肪肝小鼠模型中的保护作用研究[D]. 广州: 暨南大学, 2017. [15] 廖国玲, 杨文, 张自萍. RP-HPLC法测定不同产地宁夏枸杞甜菜碱含量[J]. 宁夏医学杂志,2007,29(6):492−493. [16] 崔治家, 刘峰林, 张启立, 等. 不同产地枸杞子中枸杞多糖含量的比较分析[J]. 华西药学杂志,2020,35(1):63−65. [17] Tai A, Gohda E. Determination of ascorbic acid and its related compounds in foods and beverages by hydrophilic interaction liquid chromatography[J]. J Chromatogr B Analyt Technol Biomed Life,2007,853(1-2):214−220. doi: 10.1016/j.jchromb.2007.03.024
[18] 杨延超, 董慧燕, 殷梦龙, 等. HPLC测定枸杞提取物中枸杞酸的含量[J]. 食品工业,2014(10):255−257. [19] 张自萍, 李弘武, 廖国玲, 等. 枸杞子中2-O-β-D-葡萄糖基-L-抗坏血酸抑制黑素合成的研究[J]. 中国新药杂志,2007(9):689−692. [20] 前田满, 中尾正宏, 深见治一. 2-O-(β-D-吡喃葡萄糖基)抗坏血酸, 其生产方法以及包含含有它的组合物的食品和化妆品: 中国, 02826317.0[P]. 2002-12-27. [21] Zhang Z, Liu X, Zhang X, et al. Comparative evaluation of the antioxidant effects of the natural vitamin C analog 2-O-β-D-glucopyranosyl-L-ascorbic acid isolated from goji berry fruit[J]. Archives of Pharmacal Research,2011,34(5):801−810. doi: 10.1007/s12272-011-0514-4
[22] 周芹, 吴玉梅. 亲水性液相色谱串联质谱法测定红甜菜中甜菜碱含量.[J]. 中国农学通报. 2019(7): 134-138. [23] 庄红艳, 姜振邦, 潘广文, 等. 离子色谱法测定枸杞子和大枣中甜菜碱含量 J]. 中华中医药杂志,2017(9):1641−1646.
[24] Toyoda-Ono, Yoshiko, et al. 2-O-(β-D-Glucopyranosyl) ascorbic acid, a Novel ascorbic acid analogue isolated from Lycium fruit[J]. Journal of Agricultural and Food Chemistry,2004,52(7):2092−2096. doi: 10.1021/jf035445w
[25] Yoshiko Toyada, et al. A novel vitamin C analog, 2-O-(beta-d-glucopyranosyl) ascorbic acid: Examination of enzymatic synthesis and biological activity.[J]. Journal of Bioence & Bioengineering,2005,99(4):361−365.
[26] 李赫, 陈敏, 马文平. 不同成熟期枸杞中类胡萝卜素含量的变化规律[J]. 中国农业科学,2006,39(3):599−605. [27] 郭荣. 枸杞果实发育过程AA-2βG、甜菜碱及黄酮含量变化研究[D]. 银川: 宁夏大学, 2008. [28] 陈敏, 李赫, 文平, 等. 反相高效液相色谱法测定枸杞中类胡萝卜素及酯类化合物[J]. 分析化学,2006,34(1):27−30. [29] Karioti A, Bergonzi M C, Vincieri F F, et al. Validated method for the analysis of goji berry, a rich source ofZeaxanthin dipalmitate[J]. Journal of Agricultural and Food Chemistry,2014,62(52):12529−12535. doi: 10.1021/jf503769s





 下载:
下载:

 下载:
下载:
