Research Progress of Biosensors in Detecting Food Allergens
-
摘要: 食物过敏是严重的公共卫生问题,它影响全世界5%的成人和8%的儿童,且患病率仍在上升。食物过敏目前尚无根治疗法,避免摄入或接触含过敏原的食物仍是患者的最佳选择。食物过敏原的检测与食物生产、标识及风险管理等息息相关,是保障食品安全的关键环节之一,故开发出快速、灵敏、准确、可重现和标准化的方法对保护过敏患者至关重要。相较于传统的检测方法,生物传感器作为一类多学科交叉融合的新兴技术,具有灵敏度高、高度自动化、易操作、响应快速和样品用量微等优点,已广泛应用于食物过敏原的检测。本文从原理、优缺点和应用等方面对光学生物传感器、电化学生物传感器、压电免疫生物传感器在检测食物过敏原上进行了阐述和总结,对生物传感器在食物过敏原检测中未来发展的趋势进行了展望,以期为快速现场定量检测食物过敏原提供参考。Abstract: Food allergy is a serious public health problem which affects 5% of adults and 8% of children in the world, and the prevalence is still rising. Because there is currently no cure for food allergy, it is still the best choice for patients that strictly avoiding substitution or contacting with allergen food. The detection of allergen in food is closely related to food production, labelling and risk management, which is one of the critical steps in guarantee of food safety. Therefore, it is critical for protecting sensitive patients to develop rapid, sensitive, accurate, reproducible and standardized methods. Compared with traditional detection methods, biosensor, as an emerging type of multi-disciplinary cross-fusion technology, takes the advantages of high sensitivity, highly automated, easy operation, fast response, less sample usage and so on. It has been widely used in the detection of food allergens. In this article, we elaborate and review the detection of food allergens by optical biosensors, electrochemical biosensors, and piezoelectric immune biosensors from the principles, advantages, disadvantages and applications. Finally, we look forward to the future development trend of biosensor in the detection of food allergens and provide a reliable analysis method for rapid on-site quantitative detection of food allergens.
-
Keywords:
- food allergens /
- detections /
- biosensors /
- aptamers /
- new nano materials
-
食物过敏是由于机体摄入某些特定食物蛋白引发的不良免疫反应,临床上属于变态反应[1-2]。它影响全世界5%的成人和8%的儿童。食物过敏原通常是水溶性或盐溶性糖蛋白。目前,已有来自123个物种的358个蛋白被鉴定为食物过敏原[3],根据过敏原的一级结构、交叉反应性和相似的生物学功能分为不同的家族,表1列出了部分重要的植物源性和动物源性的过敏原家族。摄入过敏原较短的时间内,患者会出现明显的过敏症状,如皮肤红疹、呼吸困难、消化不良、腹痛等,也可能出现严重的全身性过敏反应[4-5],但至今仍没有对食物过敏有效的治疗手段[6],唯一的办法就是采取一定的措施使过敏患者避免摄入含有过敏原的食物。2012年,我国实施《预包装食品标签通则》(GB7718-2011),鼓励企业自愿标示过敏原成分以保护消费者,但由于制造商对过敏原标签法意识缺乏,食物中出现未标注的过敏原成分的情况仍时有发生,这对过敏患者来说是一个巨大的隐患,也是形成进出口贸易壁垒的原因之一[7],故开发快速、灵敏、可重现和标准化的检测方法对食物过敏的预防和控制具备重大意义[5-6]。
分类 家族 作用 过敏原(来源) 植物源性食物过敏原
蛋白质家族醇溶蛋白 种子贮藏蛋白 Sec c 20(黑麦);Tri a 19(小麦);Tri a 36(小麦) 非特异性脂质转移蛋白 参与脂质运输,植物防御 Act d 10(奇异果);Api g 2(芹菜);Ara h 9(花生);Cas s 8(栗子);Cor a 8(榛子);Jug r 3(胡桃);Lyc e 3(土豆);Mus a 3(香蕉);Pru du 3(杏仁);Pru p 3(桃子);Tri a 14(小麦);Zea m 14/maize 2S清蛋白 种子贮藏蛋白 Ana o 3(腰果);Ara h 2(花生);Ber e 1(巴西果);Fag e 2/(荞麦);Gly m 8(大豆);Jug r 1(胡桃);Ses i 1(芝麻);Sin a 1(芥末) Bet v 1家族 发病相关蛋白 Api g 1(芹菜);Ara h 8(花生);Cor a 1(榛子);Dau c 1(胡萝卜);Gly m 4(大豆);Mal d 1(苹果);Pru p 1(桃子) Cupin超家族 7S球蛋白 种子贮藏蛋白 Ana o 1(腰果);Ara h 1(花生);Gly m 5(大豆);Jug r 2(胡桃) 11S球蛋白 种子贮藏蛋白 Ana o 2(腰果);Ara h 3(花生);Ber e 2(巴西果);Cor a 9(榛子);Gly m 6(大豆);Jug r 4(胡桃);Pru du 6(杏仁) 半胱氨酸蛋白酶C1家族 半胱氨酸蛋白酶 Act d 1(奇艺果);Gly m Bd 30K(大豆) 抑制蛋白 肌动蛋白的结合蛋白 Act d 9(奇异果);Api g 4(芹菜);Ara h 5(花生);Cuc m 2(甜瓜);Dau c 4(胡萝卜);Gly m 3(大豆);Lyc e 1(土豆);Mus a 1(香蕉);Ory s 12(米饭);Pru av 4(樱桃);Pru du 4(杏仁);Pru p 4(桃子);Tri a 12(小麦) 动物源性食物过敏原
蛋白质家族原肌球蛋白家族 肌肉中的肌动蛋白结合蛋白 Pen m 1(虾) 小清蛋白家族 肌肉蛋白,参与肌肉收缩 Cyp c 1(鲤鱼);Gad c 1(鳕鱼);Ran e 2(蛙);Sal s 1(鲑鱼);Xip g 1(旗鱼) 酪蛋白 哺乳动物乳蛋白,形成稳定的胶束复合物 Bos d 8~Bos d 12(牛奶) 转铁蛋白家族 牛奶和母鸡的蛋清中富含硫离子结合糖蛋白 Bos d Lactoferrin(牛奶);Gal d 3(鸡蛋) 丝氨酸蛋白酶抑制剂 丝氨酸蛋白酶抑制剂 Gal d 2(鸡蛋) 精氨酸激酶 三磷酸腺苷:胍基磷酸转移酶 Pen m 2(虾) 脂蛋白 载体蛋白 Bos d 5(牛奶) 溶菌酶家族 酶活性,牛奶中的乳糖合成 Bos d 4(牛奶);Gal d 4(鸡蛋) 卵类粘蛋白 Kazal型蛋白酶抑制剂 Gal d 1(鸡蛋) 清蛋白 血清白蛋白,转运蛋白 Bos d 6(牛奶);Gal d 5(鸡蛋) 生物传感器作为一类新兴的检测方法,具有快速、高灵敏度、高度自动化、实时监控等优点,近年来被广泛用于农药残留、病原微生物以及食物过敏原等方面的检测[8–10]。它主要通过生物识别元件对食物中的过敏原识别并产生响应,再由换能器转化为可定量的光电信号来实现检测。本文从原理、优缺点和应用等方面对国内外用于检测食物过敏原的生物传感器方法进行了阐述和总结,并进一步指出目前生物传感器在食物过敏原检测方面存在的不足之处以及今后的发展方向,为食物过敏原快速检测方法的建立提供参考。
1. 食物过敏原检测方法
食物过敏原传统/标准的检测方法主要分为以下三类:分子生物学检测方法,这类方法通过对过敏食物特异性DNA进行扩增来实现[11–13],如环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)、实时荧光定量PCR技术等。由于DNA在热处理和高压下保持较长时间的完整性,所以该方法比较稳定、自动化程度高,但不能检测特定的过敏原蛋白,只能瞄准其表达的特征DNA片段,DNA含量与蛋白含量没有量效关系,且蛋白才是主要导致过敏的“元凶”,所以PCR技术适合检测核酸含量高的样品,如花生、坚果、大豆、鱼和甲壳等[13-15];免疫学检测方法,该类方法基于抗原抗体之间的特异性结合,如酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)、免疫印迹等,其中ELISA法是应用范围最广的检测方法[16–18],其具备特异性强、灵敏度高、适合大批量样本检测等优点,但由于食品加工方法、人员操作和实验试剂的影响,ELISA容易出现假阳性或假阴性结果、可重复性差;色谱学检测方法,如液相色谱-质谱联用法(liquid chromatography-mass spectrograph,LC-MS/MS)、高效液相色谱法(high performance liquid chromatography,HPLC)等[19–22],其中LC-MS/MS法是我国于2019年实施的推荐性国家标准GB/T 38163-2019中规定的方法,可对牛奶、鸡蛋、大豆等食品中的部分过敏原进行检测。该法通过对过敏原的特征肽段进行鉴定来明确识别过敏原,但不适用于实时分析且设备的高昂成本可能会限制其在食品工业中的广泛应用。以上三类方法已经过几十年的发展,具有一定的优越性,同时也存在局限性,如需专业人士操作、难以现场化常规化检测等,而生物传感器作为一类近年来发展起来的方法,具有响应快速、高度自动化、部分传感器支持现场检测等优点,已成为热点研究的领域,在食物过敏原快速检测上十分具有潜力。
2. 生物传感器的原理及其应用
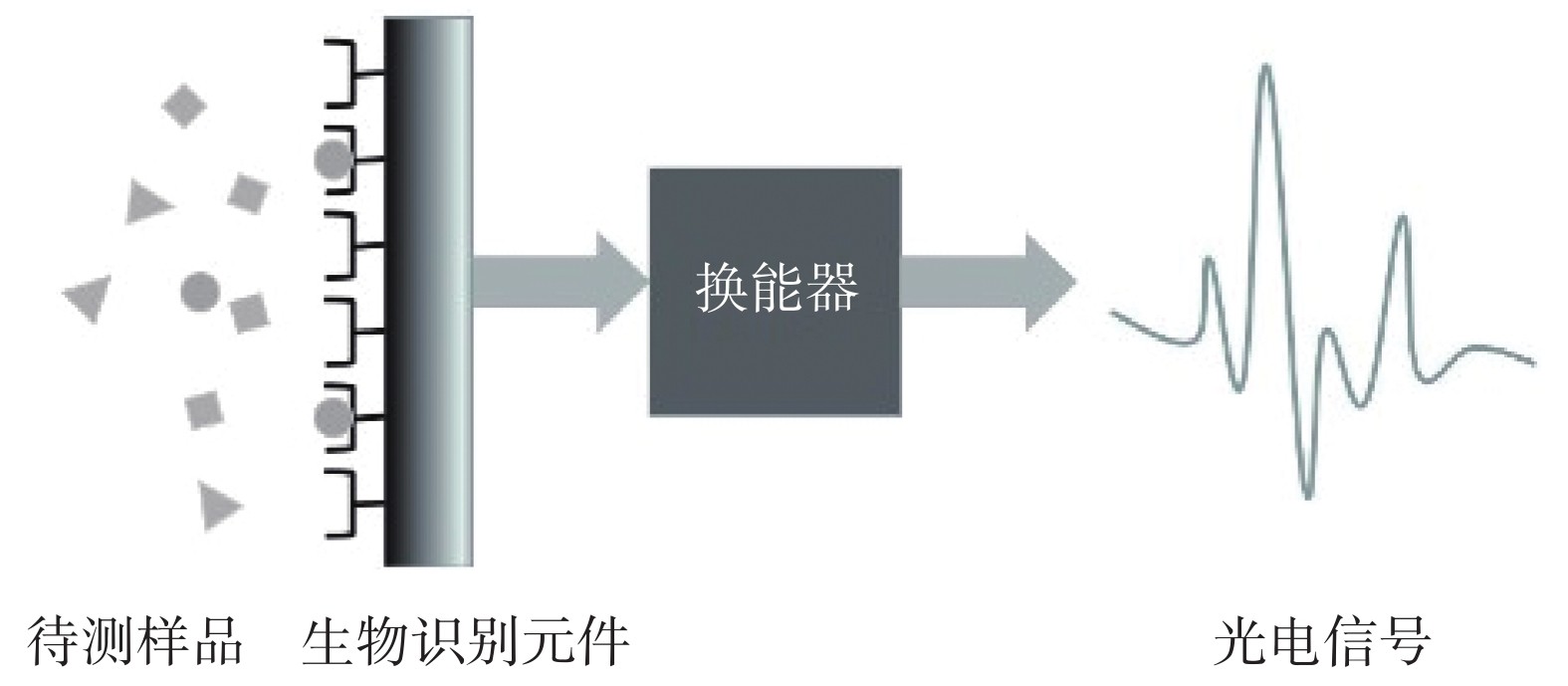
生物传感器由生物识别元件、换能器和光电信号放大装置等部分组成(图1)。生物识别元件是精确捕获目标物质的关键,不同的生物分子(如抗体、细胞等)和仿生分子(如适配体)都可用作过敏原的生物识别元件(图2)。当生物识别元件与待测样品相互作用产生化学信号,换能器将其转换为可定量检测的光电信号,再经过分析系统进行放大,从而对待测物定性及定量分析[22-24]。其中,换能器是生物传感器至关重要的组成部分,也是20世纪90年代以来许多团队想要突破和创新的地方[25]。本文根据换能器的种类,将生物传感器分为光学生物传感器、电化学生物传感器及压电免疫生物传感器进行介绍,并在表2中总结了不同类型的生物传感器的基本原理及优缺点,表3列举了用于检测牛乳过敏原β-乳球蛋白的光学生物传感器和电化学生物传感器的研究实例,可以更加清晰直观地比较各类传感器的差异。
表 2 检测食物过敏原的生物传感器的基本原理及优缺点Table 2. Pros cons and principles of various biosensors for detection of food allergens传感器类型 基本原理 优点 缺点 光学生物传感器 通过识别待测物与生物受体相互作用后对光学结构表面的有效折射率、荧光或者颜色等的变化实现待测物的检测 无需标识
样品用量少
多路复用
响应速度快仪器设备过于庞大昂贵
操作复杂电化学生物传感器 由生物识别元件作为敏感元件,电极等作为换能元件,将识别到的待测物结合到电极表面发生化学反应,从而引起电极上的电阻、电势或电流等的变化 仪器简易便携
成本低廉
操作简单
灵敏度高
适用范围广电极表面易钝化
待测样本被电活性物质干扰
长期使用稳定性差
受食品基质影响较大压电免疫传感器 将抗体固定在晶体表面,当抗原抗体结合时,质量增加,晶片的振荡频率会相应减少,通过减少值与吸附量之间的相关性对待测物进行定量分析 分析时间短
重复性好
无需标识
稳定性好不适合现场检测
检测限较低表 3 生物传感器在牛乳过敏原β-乳球蛋白检测中的应用 Table 3. Application of biosensors in the detection of milk allergen β-lactoglobulin换能器类型 检测方法 基质 线性范围(ng/mL) LOD(ng/mL) 检测时间(min) 发表时间 参考文献 光学 基于直接法的金簇REA光学免疫传感器 奶粉 − 5 × 108 30 2007 [29] 基于金纳米粒子(AuNPs)标记抗体的REA光学免疫传感器 经热处理和胰蛋白酶消化的牛奶样品 10~1×106 10 − 2009 [30] 基于直接法的多通道SPR光学免疫传感器 牛奶样品、乳清馏分和乳源产品 − 4.0×106 − 2010 [31] 基于流通式多孔氧化铝膜平台/量子点的SPR光学免疫传感器 − − 33.7 <60 2014 [32] 基于双抗体夹心法的SPR光学免疫传感器 − 5~40 5.54 − 2016 [33] 基于直接法的SPR光学免疫传感器检测 − − 164 − 2018 [34] 基于磁性纳米粒子(Fe3O4)结合碳点修饰适配体的荧光光学传感器 低致敏配方奶粉 0.25~50 0.037 − 2018 [35] 电化学 基于石墨烯固定抗β-乳球蛋白抗体的无标识伏安法电化学免疫传感器 蛋糕、奶酪零食和甜饼干 0.001~100 8.5 × 10-4 − 2012 [36] 基于适配体/石墨烯的SWV法电化学生物传感器 − 0.1~100 0.02 20 2017 [37] 基于聚苯胺-邻氨基苯甲酸/石墨(PANI/PAA)膜修饰电极的DPV电化学适配体传感器 牛奶样品 10~1000 53 40 2019 [38] 2.1 光学生物传感器
光学生物传感器通过识别待测物与生物受体相互作用后对光学结构表面的有效折射率、荧光或者颜色等的变化实现待测物的检测[39–41],依据检测信号的不同分为以下三类:共振增强吸收(resonance enhanced absorption,REA)、荧光、表面等离子共振(surfaceplasmon resonance,SPR)[28-29]。表4中列举了基于REA、荧光、SPR光学传感器的基本原理及优缺点。这三类传感器都具备响应速度快、无需标识且光学元件抗干扰能力强等优点,但REA生物传感器制作工艺复杂,荧光生物传感器虽灵敏度高但不适合现场检测,SPR生物传感器检测限相对较低。此外,大多数光学传感器的检测都需要二次再检测。
表 4 检测食物过敏原的光学传感器的基本原理及优缺点Table 4. Pros cons and principles of optical biosensors for detection of food allergens传感器类型 基本原理 优点 缺点 基于REA光学生物传感器 当抗原与金簇抗体在表面上结合时,反射镜上方产生了共振增强吸收现象,通过光学传感器观察到强烈的颜色效应进行分析 检测速度快
操作简单
无损伤分析重复性差
制作工艺复杂
难以标准化基于荧光的光学生物传感器 通过荧光信号分子与待测物结合时,荧光团内在的光物理特性被激活,进而释放出荧光信号 分析时间短
灵敏度高特定的储存条件
不适合现场检测基于SPR的光学生物传感器 金属薄膜表面固定的生物识别元件与其捕获的食物过敏原的界面处发生SPR现象,传感器实时记录光折射率的变化来进行分析 无需标识
实时监控
可高通量分析样品
样品用量微检测限较低 2.1.1 基于REA的光学生物传感器
当抗原与金簇抗体在免疫芯片的光学透明距离层的表面上结合时,金纳米粒子沉积在反射镜上方的光学近场中,产生了共振增强吸收现象,通过光学传感器可观察到强烈的颜色效应[42]。REA生物传感器与纳米金属探针联用可以得到更强的REA信号,其具有操作简单、无损伤分析等优点,但仅有极少的贵金属粗糙面才具有共振增强现象,且其制作工艺复杂难以标准化,重复性较差。Hohensinner等[29]研制了一种基于REA的新型光学生物传感器,用金簇标记的抗β-乳球蛋白抗体与过敏原结合,建立了在奶粉中检测β-乳球蛋白的方法。Maier等[42]将过敏原涂覆在芯片上,去捕获金纳米粒子标记的抗体,实现了卵清蛋白和卵类粘蛋白的检测,检测限(limit of detection,LOD)为1 ng/mL。随后,其又研制了一款基于REA的光学生物传感器去检测经热处理后的β-乳球蛋白的致敏性,结果显示β-乳球蛋白和抗体结合能力在95 ℃处理20 min和90 ℃处理60 min后仍未丧失,但抗原性降低[30]。
2.1.2 基于荧光的光学生物传感器
通过荧光信号分子与待测物结合时,荧光团内在的光物理特性被激活,进而释放出荧光信号,根据荧光强度的变化对待测物中的过敏原含量进行检测[43],其具有分析时间短、灵敏度高等优点,但荧光信号分子的荧光寿命以秒为单位,并且需要特定的储存条件,不适合现场检测。Jiang等[44]开发了以大鼠肥大细胞(RBL-2H3)为传感介质的荧光传感器,来鉴定和检测鱼类过敏原小清蛋白(parvalbumin,PV)。通过高效的脂质介导的DNA转染程序,将增强型绿色荧光蛋白(Enhanced green fluorescent protein,EGFP)质粒导入肥大细胞中以获得稳定表达绿色荧光的RBL-2H3肥大细胞株,再使用激光共聚焦扫描显微镜观察RBL-2H3细胞受过敏原刺激后的荧光强度变化。该法的线性范围为1~100 ng/mL,LOD为0.35 ng/mL。Álvarez等[32]用链霉亲和素包裹的量子点(quantum dots,QDs)标记二抗来放大信号,并通过荧光传感器检测β-乳球蛋白,LOD为33.7 ng/mL。Chen等[45]使用指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)筛选出了乳铁蛋白的两个裂解适配体,将它们的结构优化成一种新型的双结合位点分裂适配体,再将二价适配体分别与信号分子异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)和纳米粒子Ag10连接,最后基于荧光偏振法(fluorescence polarization,FP)的光学传感器检测奶粉中乳铁蛋白。通过使用了适配体和Ag10,大大提升了传感器的灵敏度,比传统的光学传感器高3个数量级,LOD为0.02 ng/mL。随后,Shi等[35]也将一种新型的荧光纳米材料碳点(carbon dots)与适配体相结合,成功建立了低致敏配方乳制品中β-乳球蛋白的检测方法,该方法的LOD为0.037 ng/mL。最近,Phadke等[46]利用核糖体展示技术筛选出两个抗αs-酪蛋白荧光肽适配体Cas1和Cas2,通过PEG24在Cas1的N端进行修饰,可以抑制β-乳球蛋白的荧光,同时增强αs-酪蛋白存在下的荧光,LOD为1008 ng/mL,与免疫层析试剂盒所需的15 min相比,基于荧光肽适配体传感器的检测时间仅要20~25 s,荧光适配体具有更加显著的识别能力和潜在的应用前景。
2.1.3 基于SPR的光学生物传感器
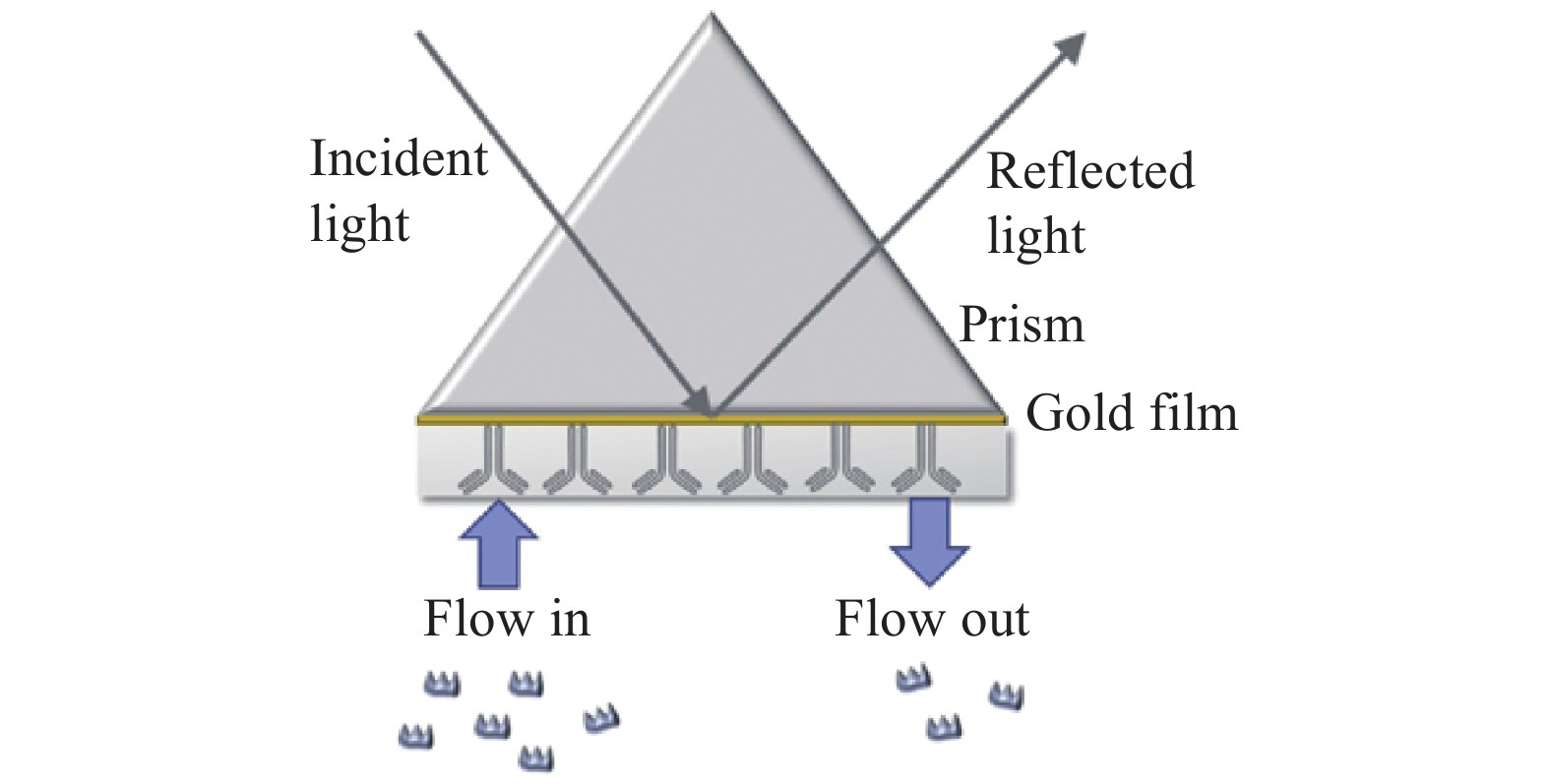
当消逝波穿过金属薄膜时,金属薄膜表面固定生物识别元件与其表面捕获的食物过敏原的界面处发生表面等离子体共振(SPR)现象,传感器实时记录光折射率的变化,通过判断食物过敏原与其受体的吸附和解离情况来定量食物过敏原(图3)[47-52]。目前,表面等离子体共振(SPR)生物传感已被开发用于蛋白质浓度的测定,它对食物过敏原、有毒蛋白质、抗体和药物蛋白质等具有极高的敏感性、无需标识、能轻松地监控各种生物分子相互识别的实时变化,但灵敏度不高,检测限偏低[53-54]。Billakanti等[31]开发了基于SPR生物传感器定量测定加工过的牛乳样品、乳清馏分和各种奶源产品中的α-乳白蛋白、β-乳球蛋白、牛血清白蛋白(bovine albumin,BSA)、乳铁蛋白和IgG的方法,平均含量为8.0×105、4.0×106、2.1×105、1.2×105和4.8×105 ng/mL,且与HPLC测出的结果之间的决定系数R2>0.97,但存在灵敏度低的缺点,需要提升传感器的性能。于是,Pollet等[50]将磁性纳米颗粒与光纤平台结合到一起,通过磁性纳米颗粒增强传感信号,利用光纤SPR传感器快速准确地检测花生过敏原Ara h 1,将LOD提高两个数量级,为90 ng/mL。Angelopoulou等[51]将微流控芯片与SPR光学传感器结合,既可以缩短反应时间,又能减少样品消耗。通过电动传输样品并引导样品到特定的位置,可同时检测酪蛋白、花生蛋白、大豆蛋白和醇溶蛋白四种不同食物过敏原,检测时间为6.5 min,LOD分别为40、1.0×103、800和100 ng/mL,与ELISA检测结果一致,且成本更低。最近,Zhou等[47]研制了一款检测原肌球蛋白(tropomyosin,TM)的传感器,将抗TM的单克隆抗体修饰在金标生物芯片表面,通过SPR传感器进行定量检测,该方法检测十分迅速,仅需3 min即可准确检测出不同贝类中TM的含量。
2.2 电化学生物传感器
电化学生物传感器将生物识别元件固定在电极表面,与识别到的待测物结合,从而引起电极上的电阻、电势或电流等的变化,进而实现待测物的检测[51-52],根据最终检测信号的不同大致可分为阻抗法、安培法和伏安法[53-54]。表5中列举了基于阻抗法、安培法和伏安法电化学传感器的基本原理及优缺点,其具有预处理过程简单、成本低、灵敏度高、便携、易于操作、适用于现场应用等优点,但重复性不好、电极表面易钝化和待测样本受表面电活性物质干扰等缺点。电化学生物传感器对成分复杂以及带有颜色的样品的检测尤其适用,被认为是最有前途的分析工具之一[54-55]。
表 5 检测食物过敏原的电化学传感器的基本原理及优缺点Table 5. Basic principle, advantages and disadvantages of electrochemical biosensors for detection of food allergens传感器类型 基本原理 优点 缺点 基于阻抗法的电化学生物传感器 通过电极表面的生物识别元件与待测物结合引起阻抗值的变化来定量分析 灵敏度高
稳定性好不能同时对多种物质进行分析 基于安培法的电化学生物传感器 当电位恒定时,待测物在电极表面或其修饰层内发生氧化还原反应,根据产生的电流随时间的变化来定量分析 结果直观
应用广泛重复性差 基于伏安法的电化学生物传感器 通过生物识别元件与待测物结合后引起电极表面电活性物质发生改变,根据峰电流强度和浓度的关系进行定量分析 稳定性好
重复性好
可同时分析多种物质灵敏度低 2.2.1 阻抗法
阻抗法电化学生物传感器是将生物识别元件固定在电极表面,当其与待测物结合时,引起电极表面阻抗值的变化来测定目标物[56–57]。这类传感器的制备过程简易,稳定性好,由于方法学的限制,它不能同时对多种物质同时进行分析。阻抗测量常分为两种:非法拉第阻抗和法拉第阻抗,前者可以在没有氧化还原对存在的情况下进行检测,在电化学生物传感器中应用较少,后者必须在有氧化还原对存在下才能测定。电化学阻抗谱(electrochemical impedance spectroscopy,EIS)是法拉第阻抗,它通过测定固体电解质的电导率、电极表面的电子传递阻抗等,从而获得生物分子之间相互作用的结果。Sun等[40]以花生过敏原Ara h 1寡核苷酸为探针,探针的5′端用硫醇标记,3′端用生物素标记,通过硫醇亲和力形成茎环结构,将探针连接到金电极表面来改良阻抗型电化学DNA传感器的灵敏度和选择性,同时用EIS测量了探针与电极之间电子转移效率的变化,该法LOD为2.22×10−5 ng/mL。Jiang等[28]将肥大细胞与阻抗型电化学传感器结合,通过模拟过敏原在体内细胞中的生理效应来实现过敏原的检测。肥大细胞的表面有大量Fc受体,可以选择性结合IgE或IgG抗体,当它与致敏原相结合后将触发脱颗粒,引起组胺、5-羟色胺和β-己糖胺酶等化学介质的释放,从而转化为可以很容易记录和量化的信号。该课题组通过此方法构建了检测河虾原肌球蛋白Pen a 1的方法,该法的LOD为150 ng/mL。随后,研究者们又结合微流控芯片技术及巨噬细胞和肥大细胞共培养系统,实现了同时进行微流控细胞培养、食物过敏原诱导的细胞形态变化和高通量过敏原的分析测定[58]。
2.2.2 安培法
安培法电化学生物传感器是当工作电极的电位恒定时,待测物在电极表面或其修饰层内发生氧化还原反应,产生的电流随时间的变化来定量分析反应中的电活性物质[59]。这类传感器因为其电极的输出信号直接和待测物的浓度呈线性关系,成为研究最多、应用最广的一类电化学传感器,但重复性差。Sun等[60]制备了电化学DNA传感器检测花生过敏原Ara h 1,用安培法监测DNA杂交,通过在电极上涂覆一层壳聚糖-多壁碳纳米管复合材料和酶联放大生物分子的电化学反应活性,以此来提高灵敏度,增大动态监测范围,该法LOD为8.26×10−7 ng/mL,线性范围为2.48×10−6~7.94×10−5 ng/mL。Ruiz-Valdepeñas等[61]使用羧酸修饰的磁珠固定酶标记的抗体,用安培法电化学免疫传感器检测α-乳白蛋白,其LOD达到0.011 ng/mL。Angulo-Ibáñez等[62]首次开发了一款基于磁珠修饰捕获抗体的夹心安培型电化学传感器去检测虾TM。通过磁珠修饰捕获抗体,可以使用外部磁铁进行快速和简单的分离,从而减少分析时间,提高在样本中捕获TM的效率,最大限度地减少了基质效应[63],其LOD为0.0469 ng/mL。该传感器简化了样品制备过程,无需纯化或浓缩阶段,可直接在食品工业中进行现场常规过敏原分析。
2.2.3 伏安法
伏安法电化学生物传感器是通过将生物识别元件固定在电极表面,目标物质与之结合后引起电极表面电活性物质发生改变,根据峰电流强度和浓度的关系准确定量,浓度越高,峰电流越大[37]。它具有制作简单、稳定性好、重复性好、可同时分析多种分析物,但灵敏度较阻抗法偏低。Cao等[64]利用聚-L-精氨酸/多壁碳纳米管(P-L-Arg/MWCNTs)复合膜对玻碳电极进行改性,通过纳米金(AuNPs)来修饰电极来促进电子转移、提高电极电导率和结合位点,进而放大反应[65]。该团队建立了一种基于循环伏安法(cyclic voltammetry,CV)和差分脉冲伏安法(differential pulse voltammetry,DPV)电化学传感器检测牛乳中酪蛋白的方法,线性范围为102~104 ng/mL,LOD为50 ng/mL。López等[66]研制了一种响应面分析法与DPV电化学传感器结合检测Ara h 2的方法。通过响应面分析法优化了捕获探针和巯基己醇(间隔物)的浓度,使得传感器的分析性能得到了提升,LOD为0.17 ng/mL。Alves等[67]通过两种单克隆抗体来建立夹心型伏安法电化学传感器用于检测食品中的Ara h 6,其线性范围为1~100 ng/mL,LOD为0.27 ng/mL,该法被应用于复杂食品基质如饼干和巧克力中Ara h 6的检测。随后,Kokkinos等[68]开发了一种基于量子点的竞争性伏安法传感器用来检测酪蛋白和免疫球蛋白G(IgG)。该方法的线性范围分别为0~5×103和0~2×103 ng/mL,LOD分别为20和40 ng/mL,该法被应用于牛乳掺假问题的检验。
2.3 压电免疫传感器
压电免疫生物传感器通常将抗体固定在晶体表面,压电晶体在振荡时存在一个基础频率,当抗原抗体结合时,质量增加,晶片的振荡频率会相应减少,通过减少值与吸附量之间的相关性对待测物进行定量分析[69]。它的优点是重复性好、检测时间短、无需标识即可实现免疫检测,可用于表征生物分子相互作用。石英晶体是最为常用的压电晶体,Sun等[70]首次将基于石英晶体微天平(quartzcrystalmicrobalance,QCM)的压电免疫传感器检测虾过敏原Pen 1;观察传感器表面特异性抗体结合时的振动变化,其LOD为333 ng/mL,检测时间仅需10 min,可重复使用13次以上。Chu等[71]将金纳米粒子(AuNPs)固定在QCM电极表面,再将鸡抗醇溶蛋白抗体直接固定在AuNPs修饰的表面,通过压电免疫传感器检测醇溶蛋白与抗体结合时频率的变化,该方法的灵敏度大为提高,LOD为8 ng/mL。随后,Funari等[72]将QCM传感器与光子固定技术相结合检测食品中的醇溶蛋白,这种技术通过紫外线照射选择性还原蛋白质中的二硫键,把抗体定向固定在QCM表面上,10 min内即可完成对实际样品中提取物的分析,该法的LOD为4×103 ng/mL。
3. 结论与展望
食物过敏原的检测与食品生产、标识及风险管理等息息相关,是确保食品安全的关键环节之一,且微量的过敏原即可引发食物过敏反应,因此高灵敏度和低检出限的生物传感器非常适合用于食物过敏原的检测。本文论述了光学、电化学和压电免疫生物传感器在检测食物过敏原的最新进展,基于目前检测食物过敏原的生物传感器所存在的缺陷,未来的改进方向主要集中在以下几个方面:食品样本基质效应大,如何从包含大量干扰成分的复杂食品基质中成功提取目的过敏蛋白,避免假阳性和假阴性结果,是样本制备的挑战之一;虽然便携式食品评估技术越来越热门,但是目前大多数生物传感器检测平台仍依赖于实验室,若能将智能手机作为传感器的现场控制或者分析工具,开发强大的智能手机应用程序,提供快速传输和数据存储功能,将大大提高生物传感器的便携性和可操作性;当前大部分的生物传感器中生物识别元件仅能识别一到两种过敏原,而实际生产中需要同时对多种过敏原进行检测,高通量快速检测是生物传感器发展的重要方向之一;由于纳米材料(如金纳米粒子、量子点和石墨烯等)具有放大信号、易于分离和良好的生物相容性等优点,在生物传感器中广泛使用以提升性能,如何进一步探索开发新型纳米材料用于超灵敏检测食物过敏原也是十分有必要的;强效有毒的化学物质作为固定材料会限制部分生物传感器的产业化应用,寻找天然材料部分或完全替代这些有毒化学物质且满足检测要求是一个可行的改进方向,如加强天然橡胶、硬明胶胶囊和玉米醇溶蛋白等材料等在其中的应用。
生物传感器检测是一类多学科交叉融合的新兴技术,它的易操作、响应快速及样品用量少等特性仍具有较大的优势。可以预见,研发出微型、智能、环保和高通量的生物传感器来监控食品加工过程中的过敏原交叉污染,能够帮助食品生产企业、食品加工商和食品安全监管部门,保护消费者权益,为快速现场定量检测食品中的过敏原提供可靠的分析方法,具有很好的应用前景。
-
分类 家族 作用 过敏原(来源) 植物源性食物过敏原
蛋白质家族醇溶蛋白 种子贮藏蛋白 Sec c 20(黑麦);Tri a 19(小麦);Tri a 36(小麦) 非特异性脂质转移蛋白 参与脂质运输,植物防御 Act d 10(奇异果);Api g 2(芹菜);Ara h 9(花生);Cas s 8(栗子);Cor a 8(榛子);Jug r 3(胡桃);Lyc e 3(土豆);Mus a 3(香蕉);Pru du 3(杏仁);Pru p 3(桃子);Tri a 14(小麦);Zea m 14/maize 2S清蛋白 种子贮藏蛋白 Ana o 3(腰果);Ara h 2(花生);Ber e 1(巴西果);Fag e 2/(荞麦);Gly m 8(大豆);Jug r 1(胡桃);Ses i 1(芝麻);Sin a 1(芥末) Bet v 1家族 发病相关蛋白 Api g 1(芹菜);Ara h 8(花生);Cor a 1(榛子);Dau c 1(胡萝卜);Gly m 4(大豆);Mal d 1(苹果);Pru p 1(桃子) Cupin超家族 7S球蛋白 种子贮藏蛋白 Ana o 1(腰果);Ara h 1(花生);Gly m 5(大豆);Jug r 2(胡桃) 11S球蛋白 种子贮藏蛋白 Ana o 2(腰果);Ara h 3(花生);Ber e 2(巴西果);Cor a 9(榛子);Gly m 6(大豆);Jug r 4(胡桃);Pru du 6(杏仁) 半胱氨酸蛋白酶C1家族 半胱氨酸蛋白酶 Act d 1(奇艺果);Gly m Bd 30K(大豆) 抑制蛋白 肌动蛋白的结合蛋白 Act d 9(奇异果);Api g 4(芹菜);Ara h 5(花生);Cuc m 2(甜瓜);Dau c 4(胡萝卜);Gly m 3(大豆);Lyc e 1(土豆);Mus a 1(香蕉);Ory s 12(米饭);Pru av 4(樱桃);Pru du 4(杏仁);Pru p 4(桃子);Tri a 12(小麦) 动物源性食物过敏原
蛋白质家族原肌球蛋白家族 肌肉中的肌动蛋白结合蛋白 Pen m 1(虾) 小清蛋白家族 肌肉蛋白,参与肌肉收缩 Cyp c 1(鲤鱼);Gad c 1(鳕鱼);Ran e 2(蛙);Sal s 1(鲑鱼);Xip g 1(旗鱼) 酪蛋白 哺乳动物乳蛋白,形成稳定的胶束复合物 Bos d 8~Bos d 12(牛奶) 转铁蛋白家族 牛奶和母鸡的蛋清中富含硫离子结合糖蛋白 Bos d Lactoferrin(牛奶);Gal d 3(鸡蛋) 丝氨酸蛋白酶抑制剂 丝氨酸蛋白酶抑制剂 Gal d 2(鸡蛋) 精氨酸激酶 三磷酸腺苷:胍基磷酸转移酶 Pen m 2(虾) 脂蛋白 载体蛋白 Bos d 5(牛奶) 溶菌酶家族 酶活性,牛奶中的乳糖合成 Bos d 4(牛奶);Gal d 4(鸡蛋) 卵类粘蛋白 Kazal型蛋白酶抑制剂 Gal d 1(鸡蛋) 清蛋白 血清白蛋白,转运蛋白 Bos d 6(牛奶);Gal d 5(鸡蛋) 表 2 检测食物过敏原的生物传感器的基本原理及优缺点
Table 2 Pros cons and principles of various biosensors for detection of food allergens
传感器类型 基本原理 优点 缺点 光学生物传感器 通过识别待测物与生物受体相互作用后对光学结构表面的有效折射率、荧光或者颜色等的变化实现待测物的检测 无需标识
样品用量少
多路复用
响应速度快仪器设备过于庞大昂贵
操作复杂电化学生物传感器 由生物识别元件作为敏感元件,电极等作为换能元件,将识别到的待测物结合到电极表面发生化学反应,从而引起电极上的电阻、电势或电流等的变化 仪器简易便携
成本低廉
操作简单
灵敏度高
适用范围广电极表面易钝化
待测样本被电活性物质干扰
长期使用稳定性差
受食品基质影响较大压电免疫传感器 将抗体固定在晶体表面,当抗原抗体结合时,质量增加,晶片的振荡频率会相应减少,通过减少值与吸附量之间的相关性对待测物进行定量分析 分析时间短
重复性好
无需标识
稳定性好不适合现场检测
检测限较低表 3 生物传感器在牛乳过敏原
β-乳球蛋白检测中的应用 Table 3 Application of biosensors in the detection of milk allergen β-lactoglobulin
换能器类型 检测方法 基质 线性范围(ng/mL) LOD(ng/mL) 检测时间(min) 发表时间 参考文献 光学 基于直接法的金簇REA光学免疫传感器 奶粉 − 5 × 108 30 2007 [29] 基于金纳米粒子(AuNPs)标记抗体的REA光学免疫传感器 经热处理和胰蛋白酶消化的牛奶样品 10~1×106 10 − 2009 [30] 基于直接法的多通道SPR光学免疫传感器 牛奶样品、乳清馏分和乳源产品 − 4.0×106 − 2010 [31] 基于流通式多孔氧化铝膜平台/量子点的SPR光学免疫传感器 − − 33.7 <60 2014 [32] 基于双抗体夹心法的SPR光学免疫传感器 − 5~40 5.54 − 2016 [33] 基于直接法的SPR光学免疫传感器检测 − − 164 − 2018 [34] 基于磁性纳米粒子(Fe3O4)结合碳点修饰适配体的荧光光学传感器 低致敏配方奶粉 0.25~50 0.037 − 2018 [35] 电化学 基于石墨烯固定抗β-乳球蛋白抗体的无标识伏安法电化学免疫传感器 蛋糕、奶酪零食和甜饼干 0.001~100 8.5 × 10-4 − 2012 [36] 基于适配体/石墨烯的SWV法电化学生物传感器 − 0.1~100 0.02 20 2017 [37] 基于聚苯胺-邻氨基苯甲酸/石墨(PANI/PAA)膜修饰电极的DPV电化学适配体传感器 牛奶样品 10~1000 53 40 2019 [38] 表 4 检测食物过敏原的光学传感器的基本原理及优缺点
Table 4 Pros cons and principles of optical biosensors for detection of food allergens
传感器类型 基本原理 优点 缺点 基于REA光学生物传感器 当抗原与金簇抗体在表面上结合时,反射镜上方产生了共振增强吸收现象,通过光学传感器观察到强烈的颜色效应进行分析 检测速度快
操作简单
无损伤分析重复性差
制作工艺复杂
难以标准化基于荧光的光学生物传感器 通过荧光信号分子与待测物结合时,荧光团内在的光物理特性被激活,进而释放出荧光信号 分析时间短
灵敏度高特定的储存条件
不适合现场检测基于SPR的光学生物传感器 金属薄膜表面固定的生物识别元件与其捕获的食物过敏原的界面处发生SPR现象,传感器实时记录光折射率的变化来进行分析 无需标识
实时监控
可高通量分析样品
样品用量微检测限较低 表 5 检测食物过敏原的电化学传感器的基本原理及优缺点
Table 5 Basic principle, advantages and disadvantages of electrochemical biosensors for detection of food allergens
传感器类型 基本原理 优点 缺点 基于阻抗法的电化学生物传感器 通过电极表面的生物识别元件与待测物结合引起阻抗值的变化来定量分析 灵敏度高
稳定性好不能同时对多种物质进行分析 基于安培法的电化学生物传感器 当电位恒定时,待测物在电极表面或其修饰层内发生氧化还原反应,根据产生的电流随时间的变化来定量分析 结果直观
应用广泛重复性差 基于伏安法的电化学生物传感器 通过生物识别元件与待测物结合后引起电极表面电活性物质发生改变,根据峰电流强度和浓度的关系进行定量分析 稳定性好
重复性好
可同时分析多种物质灵敏度低 -
[1] Sicherer S H, Sampson H A. Food allergy: a review and update on epidemiology, pathogenesis, diagnosis, prevention, and management[J]. Journal of Allergy and Clinical Immunology,2018,141(1):41−58. doi: 10.1016/j.jaci.2017.11.003
[2] Mahdavinia M. Food allergy in adults: presentations, evaluation, and treatment[J]. Medical Clinics of North America,2020,104(1):145−155. doi: 10.1016/j.mcna.2019.08.008
[3] Sova C, Feuling M B, Baumler M, et al. Systematic review of nutrient intake and growth in children with multiple IgE-mediated food allergies[J]. Nutrition in Clinical Practice,2013,28(6):669−675. doi: 10.1177/0884533613505870
[4] Ho M H K, Wong W H S, Chang C. Clinical spectrum of food allergies: A comprehensive review[J]. Clinical Reviews in Allergy and Immunology,2014,46(3):225−240. doi: 10.1007/s12016-012-8339-6
[5] Valenta R, Hochwallner H, Linhart B, et al. Food allergies: The basics[J]. Gastroenterology,2015,148(6):1120−1131. doi: 10.1053/j.gastro.2015.02.006
[6] Courtois J, Bertholet C, Tollenaere S, et al. Detection of wheat allergens using 2D western blot and mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis,2020,178(2020):112907.
[7] Monaci L, Visconti A. Immunochemical and DNA-based methods in food allergen analysis and quality assurance perspectives[J]. Trends in Food Science and Technology,2010,21(6):272−283. doi: 10.1016/j.jpgs.2010.02.003
[8] Xu H F, Zhu X, Wang J, et al. Electrochemiluminescent functional nucleic acids-based sensors for food analysis[J]. Luminescence,2019,2019, 34(3):308−315.
[9] 陈红兵. 食物过敏原检测技术的新动态[J]. 食品安全质量检测学报,2019,10(7):1743−1744. [Chen Hongbing. Update on the detection of food allergens[J]. Journal of Food Safety and Quality,2019,10(7):1743−1744. doi: 10.3969/j.issn.2095-0381.2019.07.001 [10] 郭颖慧, 霍胜楠, 孟静, 等. 食品过敏原检测技术研究进展[J]. 食品安全质量检测学报,2019,10(16):5276−5281. [Guo Yinghui, Huo Shengnan, Mengjing, et al. Research progress of detection technologies for allergen in food[J]. Journal of Food Safety and Quality,2019,10(16):5276−5281. doi: 10.3969/j.issn.2095-0381.2019.16.009 [11] Kim M J. Rapid on-site detection of shrimp allergen tropomyosin using a novel ultrafast PCR system[J]. Food Science and Biotechnology,2019,28(2):591−597. doi: 10.1007/s10068-018-0479-x
[12] Yuan D, Kong J, Li X, et al. Colorimetric LAMP microfluidic chip for detecting three allergens: Peanut, sesame and soybean[J]. Scientific Reports,2018,8(2018):8682.
[13] Villa C, Costa J, Oliveira M B P P, et al. Cow’s milk allergens: Screening gene markers for the detection of milk ingredients in complex meat products[J]. Food Control,2020,108(2020):106823.
[14] Eischeid A C. Development and evaluation of a real-time PCR assay for detection of lobster, a crustacean shellfish allergen[J]. Food Control,2016,59(2016):393−399.
[15] Costa J, Melo V S, Santos C G, et al. Tracing tree nut allergens in chocolate: A comparison of DNA extraction protocols[J]. Food Chemistry,2015,187:469−476. doi: 10.1016/j.foodchem.2015.04.073
[16] Orcajo J, Lavilla M, Martínez-De-Marañón I, et al. Specific and sensitive ELISA for measurement of IgE-binding variations of milk allergen β-lactoglobulin in processed foods[J]. Analytica Chimica Acta,2019,1052(2019):163−169.
[17] Li X, Li Z, Xu E, et al. Determination of lactoferrin in camel milk by ultrahigh-performance liquid chromatography-tandem mass spectrometry using an isotope-labeled winged peptide as internal standard[J]. Molecules,2019,24(22):1−11.
[18] Zhang M Y, Wu P, Wu J, et al. Advanced DNA-based methods for the detection of peanut allergens in processed food[J]. Trends in Analytical Chemistry,2019,114(2019):278−292.
[19] Gomaa A, Boye J. Simultaneous detection of multi-allergens in an incurred food matrix using ELISA, multiplex flow cytometry and liquid chromatography mass spectrometry (LC-MS)[J]. Food Chemistry,2015,175(2015):585−592.
[20] Wang Y, Deng R, Zhang G, et al. Rapid and sensitive detection of the food allergen glycinin in powdered milk using a lateral flow colloidal gold immunoassay strip test[J]. Journal of Agricultural and Food Chemistry,2015,63(8):2172−2178. doi: 10.1021/jf5052128
[21] Alves R C, Pimentel F B, Nouws H P A. Improving the extraction of Ara h 6 (a peanut allergen) from a chocolate-based matrix for immunosensing detection: Influence of time, temperature and additives[J]. Food Chemistry,2017,218(2017):242−248.
[22] Shukla S, Haldorai Y, K V. Electrochemical coupled immunosensing platform based on graphene oxide/gold nanocomposite for sensitive detection of cronobacter sakazakii in powdered infant formula[J]. Biosensors and Bioelectronics,2018,109(2018):139−149.
[23] Juronen D, Kuusk A, Kivirand K, et al. Immunosensing system for rapid multiplex detection of mastitis-causing pathogens in milk[J]. Talanta,2018,178(2018):949−954.
[24] Yakes B, Buijs J, Elliott C, et al. Surface plasmon resonance biosensing: Approaches for screening and characterising antibodies for food diagnostics[J]. Talanta,2016,157(2016):55−63.
[25] 王彬, 曾冬冬, 徐晓慧, 等. 电化学生物传感器的应用[J]. 北京生物医学工程,2020,39(3):311−312. [Wang Bin, Zeng Dongdong, Xu Xiaohui, et al. Application of electrochemical biosensor[J]. Beijing Biomedical Engineering,2020,39(3):311−312. doi: 10.3969/j.issn.1002-3208.2020.03.015. [26] Amor-Gutiérrez O, Buijs J, Elliott C T, et al. Folding-based electrochemical aptasensor for the determination of β-lactoglobulin on poly-l-lysine modified graphite electrodes[J]. Sensors,2020,20(8):2349. doi: 10.3390/s20082349
[27] Čadková M, Metelka R, Holubová L, et al. Magnetic beads-based electrochemical immunosensor for monitoring allergenic food proteins[J]. Analytical Biochemistry,2015,484(1):4−8.
[28] Jiang D L, Jian J, Lu A, et al. Mast cell-based electrochemical biosensor for quantification of the major shrimp allergen Pen a 1 (tropomyosin)[J]. Biosensors and Bioelectronics,2013,50(2013):150−156.
[29] Hohensinner V, Maier I, Pittner F. A ‘gold cluster-linked immunosorbent assay’: Optical near-field biosensor chip for the detection of allergenic β-lactoglobulin in processed milk matrices[J]. Journal of Biotechnology,2007,130(2007):385−388.
[30] Maier I, Lindner W, Pittner F, et al. Antigenicity of heat-treated and trypsin-digested milk samples studied by an optical immunochip biosensor[J]. Monatshefte für Chemie - Chemical Monthly,2009,140(2009):921−929.
[31] Billakanti J M, Fee C J, Lane F R, et al. Simultaneous, quantitative detection of five whey proteins in multiple samples by surface plasmon resonance[J]. International Dairy Journal,2010,20(2010):96−105.
[32] Álvarez J, Laura S, Marina C, et al. Real time optical immunosensing with flow-through porous alumina membranes[J]. Sensors and Actuators, B: Chemical,2014,202:834−839. doi: 10.1016/j.snb.2014.06.027
[33] Wu X L, Cheng Q, Cui W, et al. Two-site antibody immunoanalytical detection of food allergens by surface plasmon resonance[J]. Food Analytical Methods,2016,9(3):582−588. doi: 10.1007/s12161-015-0232-5
[34] Ashley J, Roberta D A, Monika P, et al. Development of a β-lactoglobulin sensor based on SPR for milk allergens detection[J]. Biosensors,2018,8(32):2−11.
[35] Shi M L, Cen Y, Sohail M, et al. Aptamer based fluorometric β-lactoglobulin assay based on the use of magnetic nanoparticles and carbon dots[J]. Microchimica Acta,2018,185(1):1−8. doi: 10.1007/s00604-017-2562-z
[36] Eissa S, Tlili C, L’hocine L, et al. Electrochemical immunosensor for the milk allergen β-lactoglobulin based on electrografting of organic film on graphene modified screen-printed carbon electrodes[J]. Biosensors and Bioelectronics,2012,38(2012):308−313.
[37] Eissa S, Zourob M. In vitro selection of DNA aptamers targeting β-lactoglobulin and their integration in graphene-based biosensor for the detection of milk allergen[J]. Biosensors and Bioelectronics,2017,91(2017):169−174.
[38] Lettieri M, Oana H, Alina A, et al. Beta-lactoglobulin electrochemical detection based with an innovative platform based on composite polymer[J]. Electroanalysis,2019,31(2019):1−10.
[39] Chen Y, Wang P, Wang W, et al. Optical thin film biochips for detecting allergens in food[J]. Handbook of Food Allergen Detection and Control,2015:265−271.
[40] Sun X L, Guan L, Shan X, et al. Electrochemical detection of peanut allergen ara h 1 using a sensitive dna biosensor based on stem-loop probe[J]. Journal of Agricultural and Food Chemistry,2012,60(44):10979−10984. doi: 10.1021/jf3027233
[41] Nehra M, Lettieri M, Dilbaghi N, et al. Nano-biosensing platforms for detection of cow’s milk allergens: An overview[J]. Sensors,2020,20(1):1−21. doi: 10.1109/JSEN.2019.2959158
[42] Maier I, Morgan M R A, Lindner W, et al. Optical resonance-enhanced absorption-based near-field immunochip biosensor for allergen detection[J]. Analytical Chemistry,2008,80(8):2694−2703. doi: 10.1021/ac702107k
[43] 张一芳. 基于纳米材料的生物传感技术在食品安全中的应用[D]. 长沙: 湖南大学, 2011. Zhang Y F. Analytical application of biosensing technology based on nano materials in the food safety[D]. Changsha: Hunan University, 2011.
[44] Jiang D L, Jiang H, Ji J, et al. Mast cell-based fluorescence biosensor for rapid detection of major fish allergen parvalbumin[J]. Journal of Agricultural and Food Chemistry,2014,62(27):6473−6480. doi: 10.1021/jf501382t
[45] Chen Z, Li H, Jia W, et al. Bivalent aptasensor based on silver-enhanced fluorescence polarization for rapid detection of lactoferrin in milk[J]. Analytical Chemistry,2017,89(11):5900−5908. doi: 10.1021/acs.analchem.7b00261
[46] Phadke C, Seiichi T, Izumi K, et al. Instantaneous detection of αs-casein in cow’s milk using fluorogenic peptide aptamers[J]. Analytical Methods,2020,12(10):1368−1373. doi: 10.1039/C9AY02542A
[47] Zhou J, Qi Q Q, Wang C, et al. Surface plasmon resonance (SPR) biosensors for food allergen detection in food matrices[J]. Biosensors and Bioelectronics,2019,142(4):111449.
[48] Weng X, Gaur G, Neethirajan S, et al. Rapid detection of food allergens by microfluidics ELISA-based optical sensor[J]. Biosensors,2016,6(24):2−10.
[49] Weng X, Neethirajan S. A microfluidic biosensor using graphene oxide and aptamer-functionalized quantum dots for peanut allergen detection[J]. Biosensors and Bioelectronics,2016,85(2016):649−656.
[50] Pollet J, Delport F, Janssen K P F, et al. Fast and accurate peanut allergen detection with nanobead enhanced optical fiber SPR biosensor[J]. Talanta,2011,83(2011):1436−1441.
[51] Angelopoulou M, Petrou P S, Makarona E, et al. Ultrafast multiplexed-allergen detection through advanced fluidic design and monolithic interferometric silicon chips[J]. Analytical Chemistry,2018,90(15):9559−9567. doi: 10.1021/acs.analchem.8b02321
[52] Tuteja S K, Duffield T, Neethirajan S. Liquid exfoliation of 2D MoS2 nanosheets and their utilization as a label-free electrochemical immunoassay for subclinical ketosis[J]. Nanoscale,2017,9(2017):10886−10896.
[53] Sun X B, Ye Y, He S, et al. A novel oriented antibody immobilization based voltammetric immunosensor for allergenic activity detection of lectin in kidney bean by using AuNPs-PEI-MWCNTs modified electrode[J]. Biosensors and Bioelectronics,2019,143(2019):111607.
[54] Alves R C, Barroso M F. New trends in food allergens detection: towards biosensing strategies[J]. Critical Reviews in Food Science and Nutrtion,2016,56(14):2304−2319. doi: 10.1080/10408398.2013.831026
[55] Ruiz-Valdepeñas M V, Campuzano S, Conzuelo F, et al. Electrochemical magnetoimmunosensing platform for determination of the milk allergen β-lactoglobulin[J]. Talanta,2015,131(2015):156−162.
[56] 惠媛媛, 王毕妮, 彭海霞. 电化学生物传感器在黄曲霉毒素检测中的应用研究进展[J]. 食品工业科技,2019,40(2):300−305. [Hui Yuanyuan, Wang Bini, Peng Haixia. Application research development of electrochemical biosensors in detection of aflatoxins[J]. Science and Technology of Food Industry,2019,40(2):300−305. [57] 孙秀兰, 管露, 单晓红, 等. 食品过敏原体外检测方法研究进展[J]. 东北农业大学学报,2012,43(2):126−132. [Sun Xiulan, Guan Lu, Shan Xiaohong, et al. Research on food allergen detection methods in vitro[J]. Journal of Northeast Agricultural University,2012,43(2):126−132. doi: 10.3969/j.issn.1005-9369.2012.02.025 [58] Jiang H, Jiang D L, Wang L F, et al. A novel mast cell co-culture microfluidic chip for the electrochemical evaluation of food allergen[J]. Biosensors and Bioelectronics,2016,83(2016):126−133.
[59] 关桦楠, 宋岩, 龚德状, 等. 基于电化学生物传感器检测食源性致病菌及其毒素的研究进展[J]. 食品研究与开发,2019,40(8):206−211. [Guan Huanan, Song Yan, Gong Dezhuang, et al. Research progress in the detection of food-borne pathogenic bacteria and toxins based on electrochemical biosensor[J]. Food Research and Development,2019,40(8):206−211. doi: 10.3969/j.issn.1005-6521.2019.08.036 [60] Sun X L, Jia M. Enzymatic amplification detection of peanut allergen Ara h1 using a stem-loop DNA biosensor modified with a chitosan-mutiwalled carbon nanotube nanocomposite and spongy gold film[J]. Talanta,2015,131(2015):521−527.
[61] Ruiz-Valdepeñas M V, Campuzano S, Torrente-Rodríguez R M, et al. Electrochemical magnetic beads-based immunosensing platform for the determination of α-lactalbumin in milk[J]. Food Chemistry,2016,213(2016):595−601.
[62] Angulo-Ibáñez A, Eletxigerra U. Electrochemical tropomyosin allergen immunosensor for complex food matrix analysis[J]. Analytica Chimica Acta,2019,1079(2019):94−102.
[63] Conzuelo F, Gamella M, Campuzano S, et al. Disposable amperometric magneto-immunosensor for direct detection of tetracyclines antibiotics residues in milk[J]. Analytica Chimica Acta,2012,737(2012):29−36.
[64] Cao Q, Zhao H. Electrochemical immunosensor for casein based on gold nanoparticles and poly (L-arginine)/multi-walled carbon nanotubes composite film functionalized interface[J]. Biosensors and Bioelectronics,2011,26(2011):3469−3474.
[65] Haghshenas E, Madrakian T, Afkhami A, et al. A label-free electrochemical biosensor based on tubulin immobilized on gold nanoparticle/glassy carbon electrode for the determination of vinblastine[J]. Analytical and Bioanalytical Chemistry,2017,409(22):5269−5278. doi: 10.1007/s00216-017-0471-y
[66] López M Sánchez P. Development of a genosensor for peanut allergen Ara h 2 detection and its optimization by surface response methodology[J]. Biosensors and Bioelectronics,2014,62(2014):350−356.
[67] Alves R C, Pimentel F B, Nouws H P A, et al. Detection of the peanut allergen Ara h 6 in foodstuffs using a voltammetric biosensing approach[J]. Analytical and Bioanalytical Chemistry,2015,407(2015):7157−7163.
[68] Kokkinos C, Angelopoulou M, Economou A, et al. Lab-on-a-membrane foldable devices for duplex drop-volume electrochemical biosensing using quantum dot tags[J]. Analytical Chemistry,2016,88(13):6897−6904. doi: 10.1021/acs.analchem.6b01625
[69] Farooq U, Yang Q, Ullah M W, et al. Bacterial biosensing: recent advances in phage-based bioassays and biosensors[J]. Biosensors and Bioelectronics,2018,118(2018):204−216.
[70] Sun X L, Yin Z Z, Jing D S, et al. A quartz crystal microbalance-based immunosensor for shrimp allergen determination in food[J]. European Food Research Technology,2010,231(2010):563−570.
[71] Chu Pei-Tzu, Lin C, Chen W, et al. Detection of gliadin in foods using a quartz crystal microbalance biosensor that incorporates gold nanoparticles[J]. Journal of Agricultural and Food Chemistry,2012,60(26):6483−6492. doi: 10.1021/jf2047866
[72] Funari R, Terracciano I, Della V B, et al. Label-free detection of gliadin in food by quartz crystal microbalance-based immunosensor[J]. Journal of Agricultural and Food Chemistry,2017,65(6):1281−1289. doi: 10.1021/acs.jafc.6b04830





 下载:
下载:
 下载:
下载:
