Study on Degradation Effect of Chitosan by High-speed Shear
-
摘要: 采用高速剪切技术对壳聚糖的机械降解过程进行了研究。考察了剪切时间、转速、温度、壳聚糖原溶液浓度、分子量和溶液pH等因素对壳聚糖降解效果的影响。以壳聚糖的动力黏度下降率来反映壳聚糖的降解程度,分别采用傅立叶变换红外光谱及凝胶渗透色谱对壳聚糖降解前后的结构和分子量分布进行了分析。研究结果表明,纯机械作用能够促进壳聚糖的降解,当壳聚糖原溶液浓度为3 g/L,分子量为100×104,pH为4.6,温度为40 ℃,降解时间为40 min,转速为20000 r/min时,降解效果最明显,动力黏度下降率为20.27%。研究还发现黏度对壳聚糖的机械降解过程有一定影响,当壳聚糖原溶液黏度为4.0 mPa·s时,壳聚糖的黏度下降率最大。本文为深入探究壳聚糖降解机理提供了理论依据。Abstract: The mechanical degradation process of chitosan by high-speed shear technology was studied in this paper. The effects of shear time, rotational speed, temperature, initial concentration of chitosan solution, molecular weight of chitosan and pH of solution on the degradation of chitosan were investigated. The dynamic viscosity reduction rate of chitosan was used to reflect the degradation degree of chitosan. The structure and molecular weight distribution of chitosan before and after degradation were analyzed by fourier transform-infrared spectroscopy and gel permeation chromatography, respectively. The results showed that pure mechanical action could promote the degradation of chitosan. When the initial solution concentration was 3 g/L, molecular weight of chitosan was 100×104, pH was 4.6, temperature was 40 ℃, shear time was 40 min, and rotational speed was 20000 r/min, the degradation effect was the most obvious, and the dynamic viscosity reduction rate was 20.27%.It was also found that the viscosity had a certain influence on the mechanical degradation process of chitosan. When the viscosity of chitosan solution was 4.0 mPa·s, the viscosity of chitosan decreased most. This paper provides a theoretical basis for further exploring the degradation mechanism of chitosan.
-
Keywords:
- high-speed shear /
- chitosan /
- degradation /
- mechanical effect /
- dynamic viscosity
-
壳聚糖[1-3]是甲壳素经脱乙酰作用后的一种碱性氨基多糖,具有较好的生物相容性、生物可降解性、安全性和抗菌抑菌性等优点,在化工[4]、医药[5]、食品[6]、环保[7]、农业[8]等诸多领域得到了广泛应用。但壳聚糖是一种分子量较大的高分子聚合物,只能溶于部分有机酸和少数无机酸[9-10],这在很大程度上限制了壳聚糖的应用。壳聚糖的降解产物不仅水溶性较好,并且具有许多优越的功能特性和特殊的生理活性,具有更广泛的应用,因此降解壳聚糖显得十分必要。目前壳聚糖降解的方法主要有氧化降解法[11]、酶降解法[12]、物理降解法[13]等,而物理降解方法中的水力空化法[14]和超声波法[15]由于其具有操作简单、成本低、降解产物无污染等优势得到了广泛关注,这两种方法都是基于机械-化学协同效应降解壳聚糖[16-17],机械效应与化学效应交互影响,作用机制十分复杂,较难同时探究清楚。壳聚糖 工业级,脱乙酰度 90%,深圳中发源生物科技有限公司;冰乙酸、三水合乙酸钠 分析纯,由西陇科学股份有限公司提供。
本文试图仅从机械降解的角度出发来探究壳聚糖降解的内在机制。高速剪切技术[18]是利用转子高速旋转产生的高剪切线速度和高频机械效应作用于样品,实现对样品的粉碎、研磨或分散等功能,以达到乳化或混合的目的,该技术已广泛应用于食品、制药、化妆品、涂料等诸多行业[19-20]。本文提出利用高速剪切技术来完成壳聚糖的机械降解过程,壳聚糖在定、转子狭隘的间隙中受到强烈的机械及液力剪切作用而发生糖苷键的断裂,此种方法操作简单、成本低廉、易于控制。本文研究不同操作参数及物性参数对壳聚糖降解性能的影响,探究壳聚糖机械降解过程的机制,为深入探究壳聚糖降解机理提供理论依据。
1. 材料与方法
1.1 材料与仪器
壳聚糖 工业级,脱乙酰度 90%,深圳中发源生物科技有限公司;冰乙酸、三水合乙酸钠 分析纯,由西陇科学股份有限公司提供。
T25 DS25型高速剪切机 德国IKA公司;NDJ−1B型旋转黏度计 上海昌吉地质仪器有限公司;DF−101S型集热式恒温加热磁力搅拌器 巩义市京华仪器有限责任公司;SHZ−D(Ⅲ)型循环水式多用真空泵 上海锦赋实验仪器设备有限公司;Waters1515凝胶渗透色谱仪 美国沃特世有限公司;NICOLET 6700傅里叶变换红外光谱仪 美国Thermo Fisher公司。
1.2 实验方法
1.2.1 实验装置及原理
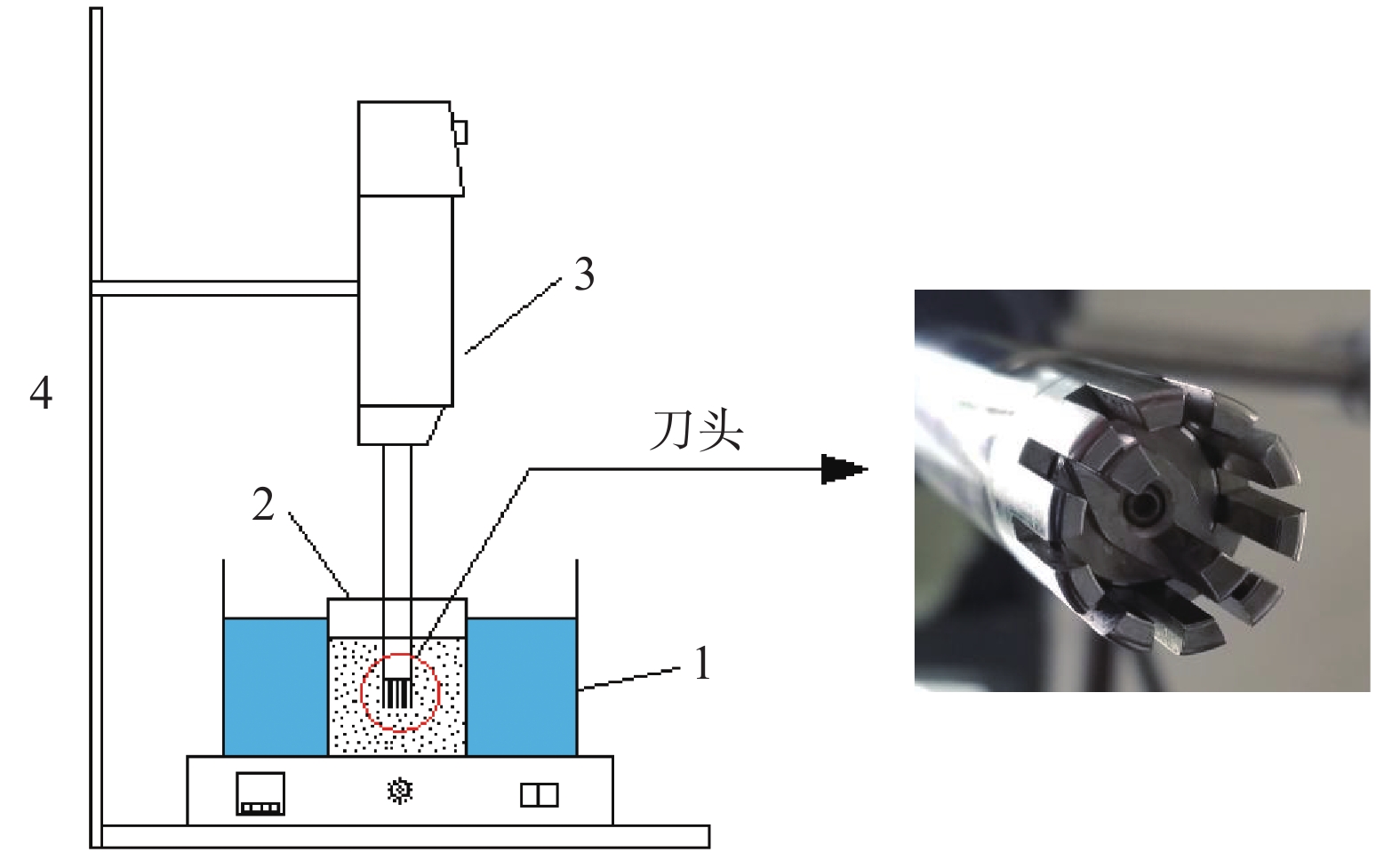
本实验的高速剪切装置如图1所示。刀头由转子和定子组成,当转子高速旋转时产生极大的剪切力作用于物料,物料在定、转子的狭小空间内受到强烈的剪切、离心挤压和撞击作用,后两者的作用最终导致物料又回到转子区域使其反复受到高速剪切作用。高速剪切过程中产生大量气泡,但气泡不会发生瞬间溃灭,不会产生空化效应,故本过程是纯机械作用于壳聚糖致使其发生降解的过程。
1.2.2 降解实验
将0.2 mol/L乙酸钠溶液与0.3 mol/L乙酸溶液以一定体积比混合配制乙酸−乙酸钠缓冲溶液,以缓冲溶液为溶剂配制一定浓度的壳聚糖溶液2 L,取200 mL 壳聚糖溶液移入烧杯中,在设定为反应温度的恒温槽中放置30 min,开启高速剪切机,在设定转速下反应一段时间,测定降解反应前后壳聚糖溶液的动力黏度,考察剪切时间、转速、温度、壳聚糖原溶液浓度、壳聚糖分子量和溶液pH等因素对壳聚糖降解效果的影响。
1.2.2.1 剪切时间对降解效果的影响
将乙酸钠溶液与乙酸溶液以体积比49:51混合均匀,调节pH为4.6,溶解分子量为100×104的壳聚糖原料,配制浓度为3 g/L的壳聚糖溶液。在温度为40 ℃、转速为12000 r/min的条件下反应不同时间(10、20、40、60、80 min),分析剪切时间对壳聚糖降解效果的影响。
1.2.2.2 转速对降解效果的影响
将乙酸钠溶液与乙酸溶液以体积比49:51混合均匀,调节pH为4.6,溶解分子量为100×104的壳聚糖原料,配制浓度为3 g/L的壳聚糖溶液。在温度为40 ℃及不同转速(4000、8000、12000、16000、20000 r/min)下反应40 min,分析转速对壳聚糖降解效果的影响。
1.2.2.3 温度对降解效果的影响
将乙酸钠溶液与乙酸溶液以体积比49:51混合均匀,调节pH为4.6,溶解分子量为100×104的壳聚糖原料,配制浓度为3 g/L的壳聚糖溶液。在转速为12000 r/min及不同反应温度(30、40、50、60、70 ℃)下反应40 min,分析温度对壳聚糖降解效果的影响。
1.2.2.4 壳聚糖原溶液浓度对降解效果的影响
将乙酸钠溶液与乙酸溶液以体积比49:51混合均匀,调节pH为4.6,溶解分子量为100×104的壳聚糖原料,配制不同浓度(1、3、5、7、9 g/L)的壳聚糖溶液。在温度为40 ℃、转速为12000 r/min的条件下反应40 min,分析壳聚糖原溶液浓度对壳聚糖降解效果的影响。
1.2.2.5 壳聚糖分子量对降解效果的影响
将乙酸钠溶液与乙酸溶液以体积比49:51混合均匀,调节pH为4.6,溶解不同分子量(10×104、50×104、100×104、200×104、500×104)的壳聚糖原料,配制浓度为3 g/L的壳聚糖溶液。在温度为40 ℃、转速为12000 r/min的条件下反应40 min,分析壳聚糖分子量对壳聚糖降解效果的影响。
1.2.2.6 溶液pH对降解效果的影响
将乙酸钠溶液与乙酸溶液以不同体积比(3:37、3:22、53:147、49:51、7:3)混合均匀,调节pH分别为(2.6、3.8、4.2、4.6、5.0),溶解分子量为100×104的壳聚糖原料,配制浓度为3 g/L的壳聚糖溶液。在温度为40 ℃、转速为12000 r/min的条件下反应40 min,分析溶液pH对壳聚糖降解效果的影响。
1.2.3 黏度下降率的测定
壳聚糖降解的过程是动力黏度下降的过程[21],本实验采用旋转黏度计测定壳聚糖降解前后的动力黏度,采用动力黏度下降率(η)来评价壳聚糖发生降解反应的程度,动力黏度下降率(η)的定义为:
式中:μ0是降解前壳聚糖原溶液的动力黏度,mPa·s;μ1是降解后壳聚糖溶液的动力黏度,mPa·s。
1.2.4 分子量分布的测定
本实验采用凝胶渗透色谱仪[22]对降解前后的壳聚糖溶液的分子量分布进行了测定。选择的实验条件为:壳聚糖原料分子量100×104,壳聚糖溶液浓度3 g/L,pH4.6,降解温度40 ℃,剪切时间40 min,转速分别为0、4000、12000、20000 r/min。
1.2.5 红外光谱分析
采用红外光谱仪[23]对降解前后的壳聚糖在波数为400~4000 cm−1范围内进行红外光谱分析。采用KBr压片法进行样品的制备:将干燥后的壳聚糖样品放入研钵内,在红外烤灯下充分研磨,再加入干燥后的KBr粉末一起研磨至混合均匀,将混合粉末置于红外压片模具中,在红外压片机上压成透明薄片后可用于测定。
1.3 数据处理
使用Origin 8.5软件处理实验数据并绘图。
2. 结果与分析
2.1 壳聚糖的降解效果
2.1.1 剪切时间对降解效果的影响
本实验考察了在不同剪切时间下壳聚糖的降解效果,实验结果如图2所示。
由图2可见,剪切时间对壳聚糖降解的影响较大。当剪切时间为10 min时,黏度下降率仅1.11%,几乎没有发生降解;随着剪切时间的延长,壳聚糖的黏度下降率逐渐增大,当剪切时间为80 min时,黏度下降率达到13.75%。出现此现象是因为在短时间内壳聚糖长链受机械剪切作用的次数较少,前期阶段受到的机械剪切效应带来的动能尚不足以使长链发生断裂,只有长链被反复多次剪切作用后才会发生断裂,剪切时间越长,剪切作用于长链的次数越多,长链更易于断裂而发生降解。因此,在本实验条件下,最佳降解时间为80 min,但剪切时间越长,能耗越高,综合考虑选择40 min剪切时间进行其它单因素实验。
2.1.2 转速对降解效果的影响
本实验考察了在不同转速下壳聚糖的降解效果,实验结果如图3所示。
由图3可见,转速对壳聚糖降解的影响较大,当转速从4000 r/min增大到20000 r/min时,壳聚糖的黏度下降率从5.15%提高到20.27%,呈直线型趋势增长。这是因为转速越大,不仅作用于壳聚糖分子的剪切力越大,而且在相同时间内作用于壳聚糖分子的次数越多,更易促使壳聚糖分子的长链发生断裂;另外,随着转速的增大,流体间的剪切作用及流体与定子、容器壁的撞击作用也会增强,在某种程度上也会促进分子链的断裂。因此,转速越大,壳聚糖的黏度下降率越高。在本实验条件下,最佳降解转速为20000 r/min,但从节能和减少机械磨损的角度考虑,选择12000 r/min转速进行其它单因素实验。
2.1.3 温度对降解效果的影响
考察了在不同温度下壳聚糖的降解效果,实验结果如图4所示。
由图4可见,随着温度从30 ℃升高到70 ℃,壳聚糖的黏度下降率先增大后降低,壳聚糖原溶液的黏度从4.70 mPa·s逐渐降低到2.88 mPa·s,当温度是40 ℃时,壳聚糖的黏度下降率最大,此时壳聚糖原溶液的黏度为4.3 mPa·s。这说明黏度对壳聚糖的机械降解过程有一定影响。黏度过大,流体的流动性较差,流体流动的阻力更大,导致壳聚糖分子被剪切的频率降低;黏度过小,由于流体的流动性太好,当转子作用于流体时,周围流体易被推离转子,导致被推开的流体未能受到转子的剪切作用,且流体间的剪切作用也减小,从而导致流体受到的剪切力大大减弱。因此,为了使剪切作用发挥最大的效果,应根据溶液的黏度选择合适的反应温度,本实验的最佳温度是40 ℃。
2.1.4 壳聚糖原溶液浓度对降解效果的影响
通过配制不同浓度的壳聚糖原溶液来考察浓度对壳聚糖降解效果的影响,实验结果如图5所示。
由图5可见,随着壳聚糖原溶液浓度的增大,壳聚糖的黏度下降率先增大后降低。当壳聚糖原溶液浓度为1 g/L时,溶液的黏度为2.6 mPa·s,当壳聚糖原溶液浓度从3 g/L增大到9 g/L时,溶液的黏度从3.9 mPa·s增大到13.4 mPa·s,且当壳聚糖原溶液浓度为3 g/L时的黏度下降率最大,此时壳聚糖原溶液的黏度是3.9 mPa·s。本实验的研究结果与2.1.3温度对壳聚糖降解效果的影响的实验结果相吻合,同样说明黏度对壳聚糖的机械降解过程有一定影响,黏度过大、过小都不利于壳聚糖的机械降解过程,而当溶液黏度在4.0 mPa·s左右时,机械剪切壳聚糖的降解效果更好。
2.1.5 壳聚糖分子量对降解效果的影响
本实验选取不同分子量的壳聚糖作为研究对象来考察原料分子量大小对壳聚糖降解效果的影响,实验结果如图6所示。
由图6可见,随着壳聚糖分子量的增大,壳聚糖的黏度下降率先增大后降低,最后趋于平缓,当壳聚糖分子量为100×104时的黏度下降率最大,此时壳聚糖原溶液的黏度是4.1 mPa·s。从图6中还可看出,当壳聚糖分子量从200×104增大到500×104时,壳聚糖原溶液的黏度仅从5.4 mPa·s增大到6.0 mPa·s,黏度增大的幅度不大,相应地壳聚糖的黏度下降率变化也不大,且趋于平缓。这是因为在其它操作条件和物性条件不变的情况下,壳聚糖原料分子量的改变表现为溶液黏度的改变,黏度变化不大,则作用于壳聚糖长链的机械剪切力相差不大,因此壳聚糖的黏度下降率变化不大,再一次证实壳聚糖的机械降解过程与壳聚糖溶液的黏度密切相关,且溶液黏度为4.0 mPa·s时,机械剪切壳聚糖的降解效果更好。
2.1.6 溶液pH对降解效果的影响
本实验考察了在不同溶液pH下壳聚糖的降解性能,实验结果如图7所示。
由图7可见,壳聚糖原溶液pH对壳聚糖降解过程的影响较大。随着pH的增大,黏度下降率逐渐增大。这是因为溶液中的H+浓度会随着pH的减小而增大,同时溶液中的阴离子浓度也会逐渐增大,使得壳聚糖形成的盐键增多[24],增加了糖苷键断裂的阻力,在同等的剪切条件下,糖苷键更难发生断裂,所以壳聚糖的黏度下降率随pH的减小而降低。从图中还可发现,当壳聚糖原溶液pH从4.6增大到5.0时,溶液的黏度下降率有一定增大,但壳聚糖原溶液的黏度仅从4.5 mPa·s变化到4.6 mPa·s,变化极小,可认为黏度微小的变化对壳聚糖降解的影响近似忽略,壳聚糖降解过程主要是由于溶液中pH变化而引起的。
2.1.7 黏度与壳聚糖降解之间的内在联系
通过2.1.1~2.1.6的研究发现,在外部条件不变的情况下,壳聚糖溶液温度、浓度、分子量的不同表现为溶液黏度的不同,黏度是影响机械剪切作用的重要因素,黏度不同导致作用于流体的剪切力不同,剪切力的强弱直接影响壳聚糖降解的程度。为了进一步找出溶液黏度与壳聚糖降解之间的内在联系,本研究以壳聚糖原溶液的黏度为横坐标,壳聚糖的动力黏度下降率为纵坐标,绘制了二者的关系图,结果如图8所示。
由图8可见,当壳聚糖原溶液的黏度在3.5~6.0 mPa·s之间时,壳聚糖的黏度下降率较大,且当黏度为4.0 mPa·s时,壳聚糖的黏度下降率最大;当壳聚糖原溶液的黏度小于3.5 mPa·s或大于6.0 mPa·s时,壳聚糖的黏度下降率都呈明显的下降趋势,说明溶液黏度过大或过小都不利于壳聚糖的降解。因此,为了能够使壳聚糖机械降解效率达到最优,可以通过改变温度、溶液浓度或分子量来调节溶液黏度至4.0 mPa·s左右,进而实现对壳聚糖机械降解过程的调控。
2.2 分子量的测定
由图9可见,随着转速从4000 r/min增大到20000 r/min,降解产物凝胶渗透色谱图的主峰逐渐由保留时间33.2 min向保留时间34.3 min的方向偏移,保留时间逐渐延长,说明壳聚糖在高速剪切作用下发生了降解,转速越高,得到的降解产物分子量越小[22,25]。另外,随着转速的增加,降解产物的峰宽逐渐变窄,说明分子量分布更为集中。由此可见,利用机械剪切的方式可以获得分子量分布更窄的降解产物。
2.3 红外光谱分析
由图10可知,位于1029和1083 cm−1处的吸收峰是壳聚糖分子中的C-O伸缩振动吸收峰[26],此处的吸收峰明显减弱,说明C-O键发生了变化,表明降解过程主要是壳聚糖分子主链发生断裂。1598 cm−1附近的吸收峰为酰胺Ⅱ(N-H)的特征吸收峰[27],此处的吸收峰略发生了偏移,且吸收峰明显增强,说明在降解过程中壳聚糖中的部分乙酰基被进一步脱除,提高了壳聚糖的脱乙酰度。899 cm−1附近的吸收峰是环伸缩振动的吸收峰[28],此处的吸收峰位置基本没变,表明壳聚糖的环状结构没有改变。由以上结果可知,壳聚糖经高速剪切作用后,主要发生壳聚糖β-(1,4)-糖苷键的断裂,部分N-乙酰基转变为氨基(-NH2),其它官能团和结构单元基本未发生变化,说明此降解方式不会改变壳聚糖降解产物的结构,且在一定程度上能提高壳聚糖的脱乙酰度。
3. 结论
本实验探究了剪切时间、转速、温度、壳聚糖原溶液浓度、壳聚糖分子量及溶液pH对壳聚糖降解效果的影响,结果表明:随着剪切时间和转速的增大,壳聚糖动力黏度下降率均逐渐增大;随着温度、壳聚糖原溶液浓度和分子量的增大,壳聚糖动力黏度下降率均先升高再降低,均在壳聚糖原溶液黏度为4.0 mPa·s左右时出现黏度下降率最大;随着pH的增大,壳聚糖动力黏度下降率逐渐增大。本实验条件下,当壳聚糖原溶液浓度为3 g/L,分子量为100×104,pH为4.6,温度为40 ℃,剪切时间为40 min,转速为20000 r/min时,降解效果最明显,动力黏度下降率可达20.27%。
壳聚糖溶液黏度对降解过程有一定影响,黏度过大或过小都不利于壳聚糖的降解,当壳聚糖溶液黏度为4.0 mPa·s时的机械降解效果最好。高速剪切技术能够有效促进壳聚糖的降解,此种方式可获得分子量分布更窄的降解产物,降解过程不会改变壳聚糖降解产物的结构,且在一定程度上能提高壳聚糖的脱乙酰度。
-
-
[1] 谢宇. 壳聚糖及其衍生物制备与应用[M]. 北京: 中国水利水电出版社, 2010: 1-5. [2] Hamed I, Özogul F, Regenstein J M. Industrial applications of crustacean by-products(chitin, chitosan, and chitooligosaccharides): A review[J]. Trends in Food Science & Technology,2016,48:40−50.
[3] 袁玥, 钱本祥, 凌新龙. 壳聚糖的改性研究进展及其应用[J]. 纺织科学与工程学报,2019,36(3):81−88. doi: 10.3969/j.issn.2096-5184.2019.03.017 [4] 王则臻, 邓启刚, 张坤, 等. 降解壳聚糖在棉织物活性染料低盐染色中的应用[J]. 化工时刊,2014(4):30−32. doi: 10.3969/j.issn.1002-154X.2014.04.009 [5] Islam S, Rahman Bhuiyan M A, Islam M N. Chitin and chitosan: Structure, properties and applications in biomedical engineering[J]. Journal of Polymers & the Environment,2017,25:854−866.
[6] 詹心瑜, 马艺超, 高彦祥. 壳聚糖在食品领域的应用研究进展[J]. 中国食品添加剂,2018(12):209−215. doi: 10.3969/j.issn.1006-2513.2018.12.027 [7] 张金生, 田中禾, 李丽华, 等. 壳聚糖及其衍生物在水处理中的应用[J]. 化工新型材料,2019,47(2):51−55. [8] Li Q P, Gooneratne S R, Wang R L, et al. Effect of different molecular weight of chitosans on performance and lipid metabolism in chicken[J]. Animal Feed Science & Technology,2016,211:174−180.
[9] 孙洪彦. 从水虿中提取壳聚糖及壳聚糖系列产品的开发应用[D]. 济南: 山东师范大学, 2015. [10] 黄永春, 袁媛, 吴宇, 等. 壳聚糖溶液水力空化泡动力学的数值模拟[J]. 现代食品科技,2014,30(5):150−155. [11] 姚邦涛, 陈继伟. 过氧化氢氧化降解法制备水溶性壳聚糖工艺的研究[J]. 造纸科技与技术,2015,34(6):60−62. [12] 张翠玲, 贲爱玲, 张凤. 超声波辅助木瓜蛋白酶降解壳聚糖研究[J]. 化工时刊,2018,32(7):6−8. [13] 任晓敏, 杨锋, 黄承都, 等. 壳聚糖的降解及其应用研究[J]. 大众科技,2018,20(225):30−33. [14] Huang Y C, Wu Y, Huang W C, et al. Degradation of chitosan by hydrodynamic cavitation[J]. Polymer Degradation and Stability,2013,98(1):37−43. doi: 10.1016/j.polymdegradstab.2012.11.001
[15] 李军立, 张波, 马力. 壳聚糖的超声波降解及最佳工艺研究[J]. 西华大学学报: 自然科学版,2011,30(5):100−103. [16] Yan J C, Ai S, Yang F. Study on mechanism of chitosan degradation with hydrodynamic cavitation[J]. Ultrasonics Sonochemistry,2020,64:105046. doi: 10.1016/j.ultsonch.2020.105046
[17] Trzcinski S, Staszewska D U. Kinetics of ultrasonic degradation and polymerisation degree distribution of sonochemically degraded chitosans[J]. Carbohydrate Polymers,2004,56(4):489−498. doi: 10.1016/j.carbpol.2004.03.017
[18] 李丽. 基于高速剪切技术的油菜蜂花粉黄酮提取工艺研究[D]. 兰州: 兰州大学, 2012. [19] 高耘, 汪树军, 刘红研, 等. 高速剪切乳化法制备硅油乳液[J]. 精细化工,2014,31(7):834−839. [20] Ye G H, Wang S L, Sia P W, et al. Development and optimization of solid dispersion containing pellets of itraconazole prepared by high shear pelletization[J]. International Journal of Pharmaceutics,2007,337(1-2):80−87. doi: 10.1016/j.ijpharm.2006.12.028
[21] 李和生, 孙玉喜, 王鸿飞. 果胶酶降解壳聚糖工艺优化及特性动态变化分析[J]. 农业机械学报,2006,37(1):83−86. doi: 10.3969/j.issn.1000-1298.2006.01.022 [22] 张帆, 王鹏飞, 黄永春. 水力空化降解壳聚糖产物分子量分布的研究[J]. 大众科技,2016,18(198):68−83. [23] 方士鑫, 王广建. 不同取代位点羧甲基壳聚糖高吸水性树脂的制备及其性能[J]. 青岛科技大学学报: 自然科学版,2020,41(4):82−87. [24] 朱新锋, 黄永春, 杨锋, 等. 低聚壳聚糖制备的研究[J]. 中国调味品,2019,44(10):68−72. doi: 10.3969/j.issn.1000-9973.2019.10.015 [25] 陈声, 侯婷婷, 江雅婷, 等. 壳聚糖分子量调控研究进展[J]. 广州化工,2019,47(23):14−19. doi: 10.3969/j.issn.1001-9677.2019.23.010 [26] Gu Z M, Cai Q Y, He Y, et al. Degradation of hyaluronan by an electrochemical process[J]. Carbohydrate Polymers,2010,82(2):521−523. doi: 10.1016/j.carbpol.2010.04.081
[27] Wang W P, Du Y M, Qiu Y L, et al. A new green technology for direct production of low molecular weight chitosan[J]. Carbohydrate Polymers,2008,74(1):127−132. doi: 10.1016/j.carbpol.2008.01.025
[28] 施晓文, 邓红兵, 杜予民. 甲壳素/壳聚糖材料及应用[M]. 北京: 化学工业出版社, 2015: 59-62.





 下载:
下载:










 下载:
下载:
