Effect of Soft-shelled Turtle Peptide on the Lifespan and Antioxidant Activities of Drosophila melanogaster
-
摘要: 目的:探讨甲鱼肽(soft-shelled turtle peptide,STP)对果蝇寿命及其抗氧化活性的影响。方法:通过酶解甲鱼肉得到甲鱼肽,测定其分子量和氨基酸组成。以不同剂量(0.2%、0.4%和0.8%)的甲鱼肽饲喂果蝇,通过生存试验以及测定果蝇体内超氧化物歧化酶(superoxide dismutase,SOD)活力、过氧化氢酶(catalase,CAT)活力和丙二醛(malondialdehyde,MDA)含量,评价甲鱼肽的抗氧化作用。结果:甲鱼肽以相对分子质量介于180~500 Da的肽段为主,含有较为丰富的脯氨酸、赖氨酸和亮氨酸等。以甲鱼肽饲喂果蝇,与对照组相比,高剂量组雌、雄果蝇的平均寿命分别显著延长了10.80%(P<0.05)和14.01%(P<0.01),平均最高寿命分别显著延长了6.35%(P<0.01)和13.22%(P<0.01)。抗氧化实验结果表明,高剂量组雌、雄果蝇的SOD活力分别显著提高了28.40%(P<0.01)和15.08%(P<0.01),CAT活力分别显著提高了33.50%(P<0.05)和38.05%(P<0.01),MDA含量分别显著下降了33.33%(P<0.01)和34.62%(P<0.01)。结论:甲鱼肽可以提高雌、雄果蝇体内抗氧化酶活力,缓解脂质过氧化作用,从而延长果蝇寿命,具有潜在抗衰老作用。Abstract: Objective: To investigate the effect of soft-shelled turtle peptide (STP) on the lifespan and antioxidant activities of Drosophila melanogaster. Methods: The soft-shelled turtle peptide was prepared by enzymatic digestion. The molecular mass distribution and amino acid composition of STP were measured.Male and female Drosophila melanogaster were fed on a diet supplemented with different doses of soft-shelled turtle peptide (0.2%, 0.4%, 0.8%). The antioxidant effect of soft-shelled turtle peptide was evaluated by analyzing the survival rate and measuring the activity of superoxide dismutase (SOD), catalase (CAT) and the content of malondialdehyde (MDA) of D. melanogaster. Results: The results showed that STP were mainly constituted with peptides which had relative molecular weight between 180 and 500 Da. Moreover, STP were rich in proline, lysine and leucine. After treating with STP, compared with the control group, mean life span in high-dose group were significantly increased by 10.80% (P<0.05) and 14.01% (P<0.01) for female and male flies. Maximum mean life-span in high-dose group were significantly increased by 6.35% (P<0.01) and 13.22% (P<0.01) for female and male flies. The activity of SOD in high-dose group were significantly increased by 28.40% (P<0.01) and 15.08% (P<0.01) for female and male flies. The activity of CAT was increased by 33.50% (P<0.05) and 38.05% (P<0.01) while the content of MDA was decreased by 33.33% (P<0.01) and 34.62% (P<0.01), respectively. Conclusion: Soft-shelled turtle peptide can increase a series of antioxidant enzyme activities and decrease lipid peroxidation to prolong life span of D. melanogaster. Thus, STP may have potential anti-aging effect.
-
衰老,通常是指随年龄的增长生物发育达到成熟期后,器官和组织逐步发生退行性变化,出现不可逆的生理衰退的现象。衰老会诱导一些常见的疾病如癌症、糖尿病、心血管疾病和神经退行性疾病的发生[1]。由于衰老涉及到多种分子机制,因此衰老的原因尚没有明确定论,目前较为有代表性的衰老学说是Harman等[2]提出的自由基损伤学说。正常情况下,机体内存在一套完整的抗氧化机制,可以清除多余的自由基[3],包括一些酶类自由基清除剂,如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等。随着机体衰老的发生和持续,这种氧化-还原平衡机制被打破,造成体内自由基过剩进一步引发脂质的过氧化,产生代谢产物丙二醛(malondialdehyde,MDA),从而造成细胞代谢及功能障碍,加速机体的衰退老化。当今社会人口老龄化加剧,延缓衰老,延长人口寿命具有重要的现实意义。以往研究表明生物活性肽有较好的抗氧化活性[4],具有潜在的延缓机体衰老的作用。红唇鱼胶原蛋白肽可以通过降低活性氧(ROS)和MDA的水平以及激活细胞内SOD、CAT和GSH-Px来保护HepG2细胞免受H2O2诱导的氧化损伤[5];贻贝肽可以降低小鼠脑组织中乳酸水平,抑制iNOS(induced nitric oxide synthase)活性,维持NO(nitric oxide)平衡,促进神经细胞存活,延缓D-半乳糖致衰老小鼠的脑退行性变化[6];叶瓜参酶解物具有较强的抗氧化活性,可以显著延长果蝇的寿命并改善D-半乳糖致衰小鼠的学习和记忆损伤[7]。由此可见,生物活性肽在抗衰老方面潜力巨大,开发新型抗衰老活性肽具有重要的科学意义。
甲鱼又称鳖、脚鱼,是一种水生经济动物,在我国一直被视为营养美容食品,素有强身健体、延年益寿之功效[8]。甲鱼富含蛋白质、矿物质元素和不饱和脂肪酸,具有较高的保健作用和经济价值[9]。甲鱼蛋白经过酶解后可得到甲鱼肽(soft-shelled turtle peptide, STP),研究表明甲鱼肽具有多种生理功能,屈思雨等[9]发现甲鱼肉蛋白酶解物表现出较好的ABTS和氧自由基清除能力;Wang等[10]从中华鳖蛋白水解物中分离出三种新型抗增殖肽,对人肺癌细胞A549具有抗增殖活性;还有研究通过酶解鳖甲制备出两种活性肽,可以非竞争性抑制血管紧张素I转化酶[11]。目前对甲鱼肽的研究主要集中体外抗氧化、抗肿瘤、调节免疫、降血压等功能,但在寿命及体内抗氧化活性层面的研究还较少。因此,研究甲鱼肽对寿命及体内抗氧化活性的影响可以为探究其潜在的抗衰老功能提供一定的理论基础。在抗衰老研究中,果蝇常作为衰老试验的动物模型,其优点在于生命周期短、繁殖力强、遗传背景清晰、成本低[12]。因此本实验选取果蝇为动物模型,以添加不同剂量的甲鱼肽的培养基饲喂果蝇,通过果蝇的生存试验及测定果蝇体内SOD、CAT活力和MDA含量,来评价甲鱼肽对果蝇寿命及其体内抗氧效果,以期为甲鱼肽的抗衰老相关产品的开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
甲鱼 冷江鳖业有限公司;动物蛋白酶A1 南宁庞博生物工程有限公司;黑腹果蝇野生型Canton-S 浙江大学食品生物科学技术研究所馈赠;酵母粉、玉米粉、白砂糖 市场购买;SOD、MDA、CAT、考马斯亮蓝蛋白测定试剂盒 南京建成生物有限公司;氯化钠、丙酸、琼脂 分析纯,国药集团化学试剂有限公司;其他试剂 分析纯,上海国药集团。
DKS-24电热恒温水浴锅 嘉兴市中新医疗仪器有限公司;R-1005长城旋转蒸发仪 郑州长城仪器有限公司;冷冻干燥机 北京博医康试验仪器有限公司;通风柜 浙江三和科教仪器有限公司;智能人工气候箱 宁波海曙赛福实验仪器厂;立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;-80 ℃ZKU-LZ型超低温冰箱 中科生命科技股份有限公司;BS124型分析电子天平 赛多利斯科学仪器(北京)有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;Infinite M2000酶标仪 瑞士Tecan公司。
1.2 实验方法
1.2.1 甲鱼肽的制备
方法参考李琳等[13]的制备方法,将购于冷江鳖业有限公司的甲鱼,清洗干净, 切块后包装于双层聚乙烯袋中, 置于−20 ℃冷冻备用。甲鱼肽的制备流程如下:甲鱼→蒸煮3 h→去脂→匀浆→加入蛋白酶0.4%→50 ℃酶解6 h→沸水浴中灭酶20 min→过滤→10000 r/min 离心15 min→取上清液→冷冻干燥→甲鱼肽粉。
1.2.2 甲鱼肽的分子质量及分布
采用凝胶过滤色谱法分析甲鱼肽分子质量分布[14]。样品处理方法:称取0.02 g样品,用流动相定容至10 mL,混匀过0.22 μm的微孔滤膜后进样。
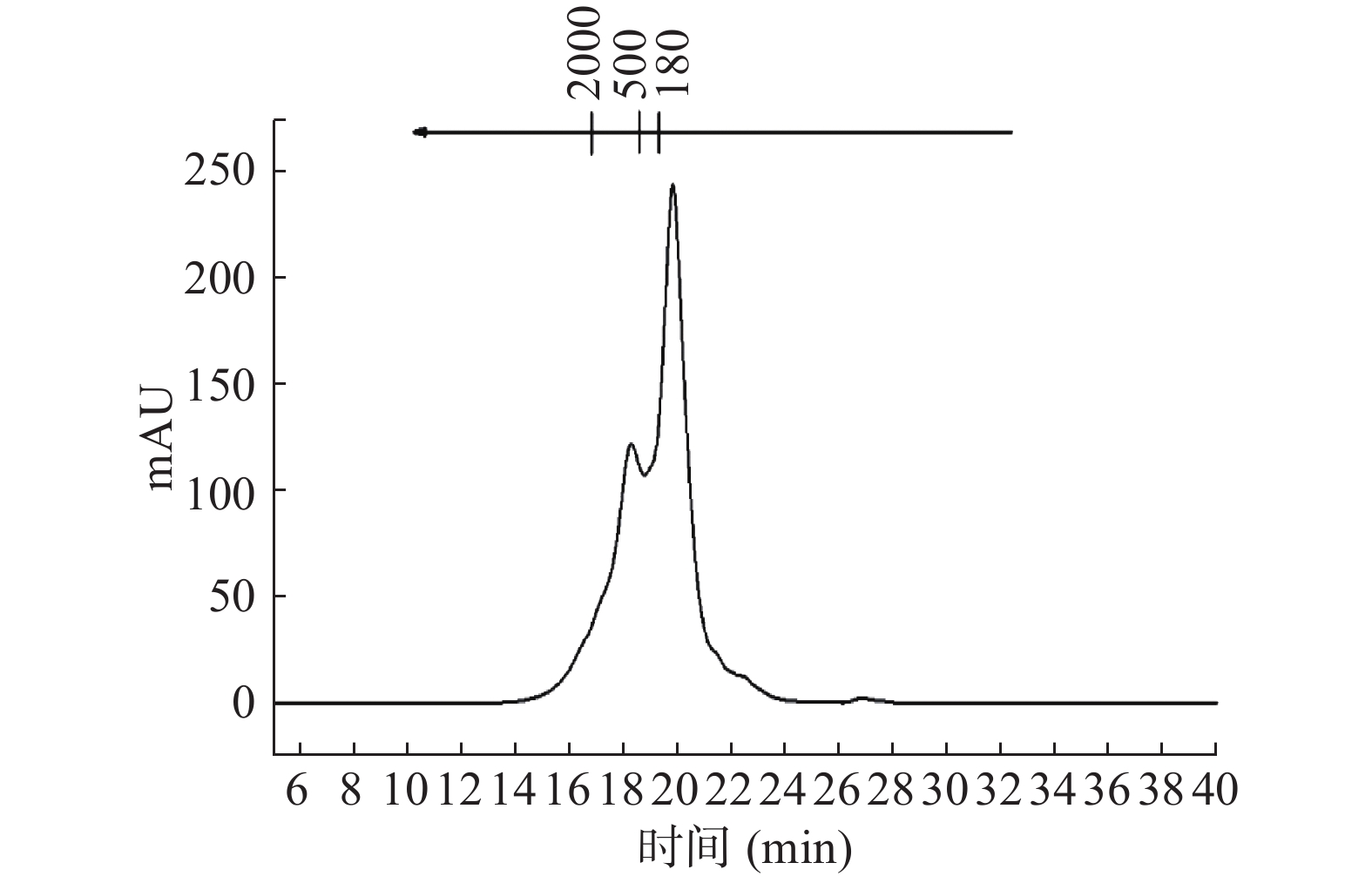
色谱条件:TSKgel 2000 SWXL分析柱(300 nm×7.8 mm);流动相体积比为乙腈:水:三氟乙酸=450:550:1(v/v/v);流速0.5 mL/min;柱温30 ℃;检测波长220 nm;运行时间40 min;选用细胞色c(分子质量12400 Da)、抑肽酶(分子质量6512 Da)、杆菌肽(分子质量1450 Da)、甘氨-甘氨-色氨-精氨酸(分子质量451 Da)和甘氨酸-甘氨酸-甘氨酸(分子质量189 Da)为标准品。以保留时间对标准品的相对分子质量对数作标准曲线,得到y=−0.2187x+6.7329(R2=0.9901),其中,y为标准肽样品分子质量的对数,x为保留时间,min,从而得到甲鱼肽的相对分子质量。
1.2.3 氨基酸组成的测定
1.2.3.1 样品前处理
参考吕艳[15]的方法,精确称取20 mg样品于消解瓶中,加入1 mL 6 mol/L HCl后立即充入氮气并封口,移入150 ℃恒温箱中加热1.5 h,取出冷却;氨基酸标液:准确称取氨基酸对照品各10 mg于25 mL容量瓶中,加0.1 mol/L HCl超声溶解并定容。
1.2.3.2 氨基酸的衍生化反应
流动相A:0.1mol/L 乙酸钠溶液(含3%乙腈和0.1%三乙胺),用乙酸调节pH至6.5;流动相B:80%乙腈,使用前超声脱气处理;再干燥液为乙醇:水:三乙胺=2:2:1;衍生溶液为异硫氰酸苯酯:乙醇:三乙胺:水=1:7:1:1;样品稀释液为流动相A:流动相B=9:1;衍生条件:取1、5、10、15、20 μL氨基酸标准液和6 μL水解液分别置于1.5 mL离心管,氮气吹干后加入10 μL再干燥液,氮气吹干后加入20 μL衍生溶液并涡旋混匀,室温静置20 min后再次氮气吹干,加入50 μLB相,涡旋混匀后再加入450 μLA相,再次涡旋混匀后过膜、上机。
1.2.3.3 高效液相色谱的测定条件
色谱柱:C18(4.6 mm×250 mm,5 μm);柱温38 ℃;进样量10 μL;检测波长254 nm;流速1.0 mL/min;流动相A为0.1 mol/L乙酸钠溶液(含3%乙腈和0.1%三乙胺),用乙酸调pH至6.5;流动相B:80%乙腈(表1)。
表 1 梯度洗脱时间Table 1. Gradient elution time时间(min) 流速(mL/min) 流动相A(%) 流动相B(%) 0 1.0 100 0 13 1.0 93 7 23 1.0 77 23 29 1.0 65 35 35 1.0 60 40 40 1.0 0 100 45 1.0 0 100 47 1.0 100 0 50 1.0 100 0 1.2.4 果蝇培养基的制备基
础培养基配方为纯水1000 mL、玉米粉105 g、琼脂7.5 g、蔗糖75 g、酵母粉40 g和丙酸5 mL。参考肖发[16]的方法,将蔗糖和琼脂一同放入锅中,不断搅拌直至琼脂条融化,加入酵母粉后继续搅拌,最后加入冲调好的玉米糊,不断搅拌直至饲料粘稠,停止加热,置于高压灭菌锅灭菌。冷却至80 ℃后加入5 mL丙酸,充分搅拌后置于60 ℃水浴保温。样品培养基配制方法:在基础培养基中添加甲鱼肽,分别配制质量浓度为0.2%、0.4%、0.8%的低、中、高剂量的培养基,搅拌均匀后分装于瓶(40 g/瓶)和试管(5 g/管)中,室温放置凝固后再转移到培养箱中备用。
1.2.5 果蝇生存实验
在基础培养基中按照0.2%、0.4%和0.8%的比例添加甲鱼肽饲喂果蝇,以基础饲料饲喂的果蝇为对照组。选取24 h内羽化的果蝇,二氧化碳麻醉后鉴定性别,然后将果蝇置于各实验组的试管中进行饲喂,每支试管饲喂10只果蝇,每个试验组雌雄果蝇各设置10个重复。将各组果蝇置于25 ℃恒温培养箱中培养,每3 d更换新的培养基,同时记录果蝇死亡数量,直至果蝇全部死亡。参考王耀辉等[17]的方法,统计果蝇的半数死亡时间、最高寿命和平均寿命,并以果蝇的存活率为纵坐标,培养天数为横坐标分别绘制雌雄果蝇的生存曲线。平均寿命、最高寿命、半数死亡时间和存活率的计算公式如下:
(式1) (式2) (式3) (式4) (式5) 1.2.6 果蝇抗氧化活性实验
参考张明等[18]的实验方法并稍作调整。于20、40 d时,将各组果蝇麻醉后加入冰冷的生理盐水制备10%组织匀浆。于4 ℃,8000 r/min离心20 min,取上清液测定相关抗氧化指标。参照试剂盒说明书,测定每组雌雄果蝇上清液中总SOD活性、MDA含量及CAT活力。
1.3 数据处理
数据以Mean ± SD表示,采用SPSS 22.0软件进行单因素方差分析(One-way ANOVA),和对照组相比,*,差异显著(P<0.05),**,差异极显著(P<0.01)。使用Graphpad Prism 8.0软件绘图。
2. 结果与分析
2.1 甲鱼肽分子质量分布
近几年研究发现,小分子量的肽段具有较高的抗氧化活性,申彩红[19]发现分子量在130~2000 Da的海参寡肽的抗氧化性优于2000~5000 Da的海参多肽。赵翊君[20]发现鲈鱼鱼肉酶解产物中最小的肽段表现出最强的抗氧化能力。由图1和表2可知,甲鱼肽的分子质量主要集中在1000 Da以下,相对含量为93.23%。按照氨基酸残基评价分子量110 Da 估算[21],甲鱼肽中二肽和三肽(180~500 Da)的组分含量较多,相对含量约为56.05%。说明甲鱼肽主要以小分子肽段为主,具有潜在的抗氧化活性。
表 2 甲鱼肽分子质量分布Table 2. Molecular mass distribution of STP分子质量(Da) 保留时间(min) 峰面积比例(%) 3000~5000 14.49~15.41 0.11 2000~3000 15.41~16.98 0.60 1000~2000 16.98~18.31 6.06 500~1000 18.31~19.86 23.68 180~500 19.86~20.47 56.05 <180 >20.47 13.50 2.2 甲鱼肽氨基酸组成
脯氨酸、亮氨酸、赖氨酸、缬氨酸、丙氨酸、苯丙氨酸、异亮氨酸被普遍认为具有抗氧化活性[6,14],其中亮氨酸、缬氨酸和异亮氨酸这类支链氨基酸可以延长酵母、小鼠的平均寿命,具有延缓衰老的潜能[22-23],精氨酸也与延缓衰老及衰老相关疾病密切相关[24]。如表3所示,甲鱼肽中具有抗氧化活性的7种氨基酸含量为43.51%。同时,甲鱼肽中亮氨酸、缬氨酸和异亮氨酸这三种支链氨基酸含量较高,约为17.70%,精氨酸的含量为4.11%。因此,甲鱼肽富含抗氧化和抗衰老活性的氨基酸,推测其可能具有延缓衰老的作用。
表 3 甲鱼肽氨基酸组成Table 3. Amino acid composition of the STP氨基酸名称 含量(mg/g) 含量(%) 天冬氨酸 59.81 7.86 谷氨酸 115.02 15.11 丝氨酸 23.72 3.12 甘氨酸 119.99 15.76 组氨酸 9.18 1.21 精氨酸 31.28 4.11 苏氨酸 22.84 3.00 丙氨酸 56.15 7.38 脯氨酸 65.96 8.67 酪氨酸 21.14 2.78 缬氨酸 35 4.60 甲硫氨酸 14.89 1.96 胱氨酸 12.22 1.61 异亮氨酸 50.61 6.65 亮氨酸 49.09 6.45 苯丙氨酸 23.68 3.11 赖氨酸 50.59 6.65 总氨基酸 761.17 100 2.3 甲鱼肽对果蝇寿命的影响
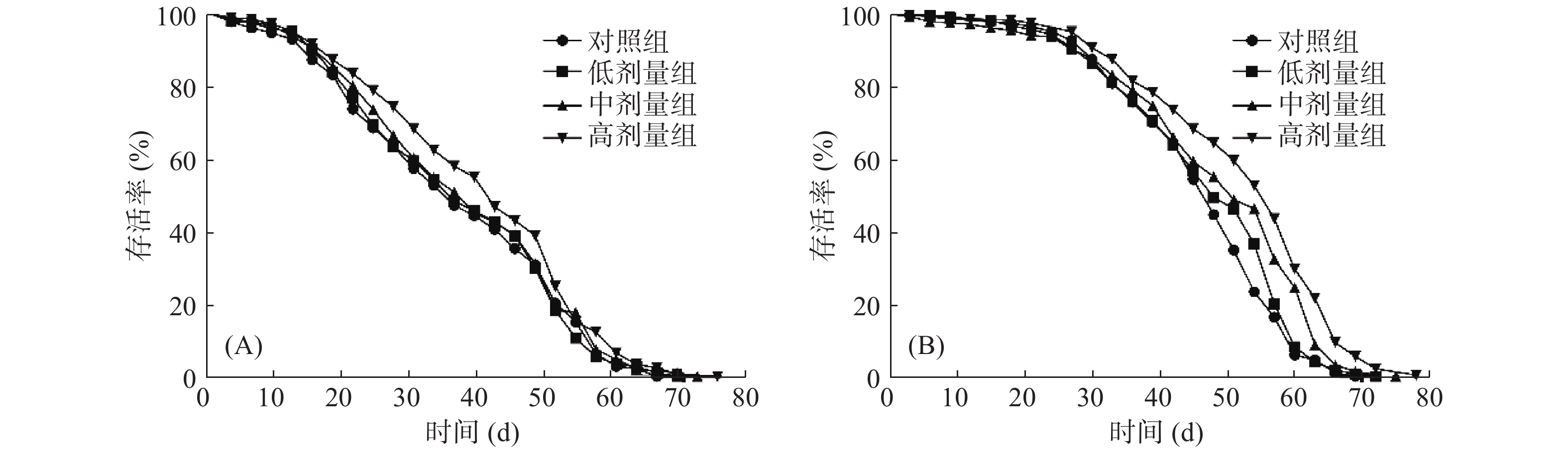
寿命是评价抗衰老药物效果的重要指标,寿命试验又称为生存试验,可以通过统计果蝇的平均寿命、半数死亡时间和最高寿命来研究衰老规律和抗衰老效应[6]。由表4可知,甲鱼肽高剂量组的雌果蝇和雄果蝇半数死亡时间均显著高于对照组(P<0.05),高剂量组的雌雄果蝇相比对照组分别延长了6 d和9 d,中剂量组虽然也延长了雌雄果蝇的半数死亡时间,但无显著性差异(P>0.05)。所有实验组均表现出延长雌、雄果蝇的平均寿命的效果。低、中、高剂量组的雌性果蝇的平均寿命分别延长了1.51%、3.87%、10.80%,其中高剂量组与对照组相比有显著性差异(P<0.05),低、中、高剂量组雄性果蝇的平均寿命分别延长了2.29%、6.01%、14.01%,其中高剂量组与对照组相比有极显著性差异(P<0.01)。不同剂量的甲鱼肽均表现出延长雌雄果蝇的平均最高寿命的效果,相比对照组,高剂量组雌性果蝇的平均最高寿命极显著延长了6.35%(P<0.01),中剂量组、高剂量组雄性果蝇的平均最高寿命分别显著延长了5.71%、13.22%(P<0.01)。雄果蝇的半数死亡时间、平均寿命、平均最高寿命均比雌果蝇增加幅度大,说明甲鱼肽对雄果蝇寿命影响略高于雌果蝇,这可能是雌性果蝇与雄性果蝇对受试药物的敏感性不同造成的[25]。
表 4 甲鱼肽对果蝇寿命的影响Table 4. Effects of STP on life span in D. melanogaster组别 半数死亡时间(d) 平均寿命(d) 平均最高寿命(d) 平均寿命延长率(%) 雌 雄 雌 雄 雌 雄 雌 雄 对照组 36 48 36.40±0.97 46.18±0.72 60.31±0.64 63.41±0.61 − − 低剂量组 36 48 36.95±0.93 47.24±0.78 60.83±0.81 64.39±0.65 1.51 2.29 中剂量组 39 51 37.81±0.96 48.96±0.88 62.04±0.89 67.03±0.54** 3.87 6.01 高剂量组 42** 57** 40.33±0.93* 52.6±0.83** 64.14±0.82** 71.79±0.73** 10.80 14.01 注:*表示各剂量组与对照组相比差异显著,P<0.05;**表示各剂量组与对照组相比差异极显著,P<0.01;表5~表7同。 图2是雌雄果蝇的生存曲线,由图2可知,在0~20 d,对照组和各剂量组存活率差异不显著(P>0.05),之后实验组的曲线逐渐高于对照组,各剂量组的存活率均高于对照组,且高剂量组的延寿效果最好。综合表4和图2的结果,分析果蝇半数死亡时间、平均寿命、平均最高寿命及果蝇不同时期的存活率,发现高剂量组延长雌雄果蝇寿命的效果最好。
2.4 甲鱼肽对果蝇体内抗氧化活性的影响
自由基学说是目前较有说服力的衰老理论之一,它认为随着衰老的发生,机体抗氧化酶活力降低,因此机体清除自由基能力降低,代谢累积形成的自由基会对机体造成氧化损伤[26]。SOD可以使
2.4.1 甲鱼肽对SOD活力的影响
SOD作为体内抗氧化酶之一,可以清除自由基,使
组别 雌果蝇SOD活力(U/mg prot) 雄果蝇SOD活力(U/mg prot) 20 d 40 d 20 d 40 d 对照组 264.71 ±12.85 243.67 ± 5.90 358.33 ±5.84 328.71 ± 10.32 低剂量组 273.44 ±9.58 250.65 ± 8.77 368.35 ± 4.87 347.70 ±9.37 中剂量组 285.35 ±10.39 263.37 ± 7.64* 377.40 ± 6.97* 361.06 ± 8.39* 高剂量组 334.13 ±10.14** 312.90 ± 7.21** 383.68 ± 3.96** 378.28 ± 8.82** 2.4.2 甲鱼肽对MDA含量的影响
随着年龄的增长,机体清除自由基能力下降,自由基的堆积使脂质发生过氧化反应生成代谢产物MDA[30]。MDA的含量间接反映了衰老果蝇中细胞的损伤严重程度,是研究衰老的重要指标。不同剂量甲鱼肽对雌性和雄性果蝇体内MDA活力的影响见表6。由表6可知,MDA含量随着果蝇生长时间的延长而呈现升高的趋势,这是因为随着果蝇的衰老,清除体内自由基的能力降低,体内脂质过氧化物增多[31-32]。雄果蝇体内MDA含量低于雌果蝇,这可能是由于雄蝇体内的脂质含量少,过氧化脂质程度较低,这与张碧莹等[33-34]研究结果一致。
表 6 甲鱼肽对果蝇MDA含量的影响Table 6. Effects of STP on MDA content in D. melanogaster组别 雌果蝇MDA含量(nmol/mg prot) 雄果蝇MDA含量(nmol/mg prot) 20 d 40 d 20 d 40 d 对照组 0.33 ± 0.04 0.36 ±0.01 0.25 ± 0.02 0.26 ± 0.02 低剂量组 0.30 ± 0.02 0.32 ± 0.04 0.23 ± 0.01 0.22±0.03 中剂量组 0.27 ± 0.03 0.29 ± 0.01* 0.19 ±0.02* 0.20 ± 0.01* 高剂量组 0.24 ±0.02* 0.24 ± 0.01** 0.16 ±0.03** 0.17 ± 0.01** 20 d时,相比对照组,高剂量组的雌果蝇体内MDA含量下降了27.27%(P<0.05),其他剂量组MDA含量也有所降低,但无显著性差异(P>0.05);40 d时,相比同时间的对照组,中、高剂量组的雌果蝇体内MDA含量分别下降了19.44%(P<0.05)和33.33%(P<0.01)。第20 d时,相比对照组,中、高剂量组的雄果蝇体内MDA含量下降了24.00%(P<0.05)和36%(P<0.01);40 d时,相比同时间的对照组,中、高剂量组的雄果蝇体内MDA含量分别下降了23.07%(P<0.05)和34.62%(P<0.01)。综上所述,MDA含量会随着年龄增长而增加,不同质量浓度的甲鱼肽能够降低果蝇体内MDA含量,且有剂量依赖性。
2.4.3 甲鱼肽对CAT活力的影响
过氧化氢酶也是机体抗氧化酶体系的重要一员,可以通过清除机体产生的 H2O2,降低组织中过氧化物的产生来延缓衰老[34]。不同剂量甲鱼肽对雌性和雄性果蝇体内CAT活力的影响见表7。由表7可知,20 d时,相比对照组,低、中和高剂量组的雌果蝇体内CAT活力提高了39.73%(P<0.05)、69.16%(P<0.01)和53.67%(P<0.01)。40 d时,相比同时间的对照组,中、高剂量组的雌果蝇体内CAT活力分别提高了37.64%(P<0.05)和33.50%(P<0.05)。对于雄果蝇,20 d时,相比对照组,中、高剂量组的雄果蝇体内CAT活力提高了33.46%(P<0.05)和42.36%(P<0.01)。40 d时,相比同时间的对照组,中、高剂量组的雄果蝇体内CAT活力提高了30.79%(P<0.01)和38.05%(P<0.01)。综上所述,不同质量浓度的甲鱼肽能够提高果蝇体内CAT活力。
表 7 甲鱼肽对果蝇CAT活力的影响Table 7. Effects of STP on CAT activity in D. melanogaster组别 雌果蝇CAT活力(U/mg prot) 雄果蝇CAT活力(U/mg prot) 20 d 40 d 20 d 40 d 对照组 57.03 ± 3.22 63.49 ± 4.56 117.25 ± 9.19 85.33 ± 6.49 低剂量组 79.69 ± 9.54* 83.80 ± 9.81 146.01 ± 10.84 99.73 ± 3.13 中剂量组 96.47 ± 5.91** 87.39 ±4.41* 156.48 ± 7.50* 111.60 ± 6.62** 高剂量组 87.64 ± 8.70** 84.76 ± 10.45* 166.92 ± 19.08** 117.80 ± 8.99** 3. 结论
甲鱼肽以相对分子质量介于180~500 Da的肽段为主,且含有较为丰富的具有抗氧化活性的氨基酸:如脯氨酸、赖氨酸和亮氨酸等。不同剂量的甲鱼肽均能延长雌雄果蝇的寿命,提高其体内抗氧化指标,并且在相同剂量下,甲鱼肽对雄果蝇延长寿命及提高体内抗氧化活性的效果优于雌果蝇。综上所述,本研究推测甲鱼肽具有潜在的抗衰老功效,为甲鱼肽在医药、保健品领域中的应用提供了一定的参考。但由于衰老机制较为复杂,后续可在大鼠和细胞的水平上进一步开展抗衰老功能的研究,为甲鱼肽抗衰老的作用提供更多的依据。
-
表 1 梯度洗脱时间
Table 1 Gradient elution time
时间(min) 流速(mL/min) 流动相A(%) 流动相B(%) 0 1.0 100 0 13 1.0 93 7 23 1.0 77 23 29 1.0 65 35 35 1.0 60 40 40 1.0 0 100 45 1.0 0 100 47 1.0 100 0 50 1.0 100 0 表 2 甲鱼肽分子质量分布
Table 2 Molecular mass distribution of STP
分子质量(Da) 保留时间(min) 峰面积比例(%) 3000~5000 14.49~15.41 0.11 2000~3000 15.41~16.98 0.60 1000~2000 16.98~18.31 6.06 500~1000 18.31~19.86 23.68 180~500 19.86~20.47 56.05 <180 >20.47 13.50 表 3 甲鱼肽氨基酸组成
Table 3 Amino acid composition of the STP
氨基酸名称 含量(mg/g) 含量(%) 天冬氨酸 59.81 7.86 谷氨酸 115.02 15.11 丝氨酸 23.72 3.12 甘氨酸 119.99 15.76 组氨酸 9.18 1.21 精氨酸 31.28 4.11 苏氨酸 22.84 3.00 丙氨酸 56.15 7.38 脯氨酸 65.96 8.67 酪氨酸 21.14 2.78 缬氨酸 35 4.60 甲硫氨酸 14.89 1.96 胱氨酸 12.22 1.61 异亮氨酸 50.61 6.65 亮氨酸 49.09 6.45 苯丙氨酸 23.68 3.11 赖氨酸 50.59 6.65 总氨基酸 761.17 100 表 4 甲鱼肽对果蝇寿命的影响
Table 4 Effects of STP on life span in D. melanogaster
组别 半数死亡时间(d) 平均寿命(d) 平均最高寿命(d) 平均寿命延长率(%) 雌 雄 雌 雄 雌 雄 雌 雄 对照组 36 48 36.40±0.97 46.18±0.72 60.31±0.64 63.41±0.61 − − 低剂量组 36 48 36.95±0.93 47.24±0.78 60.83±0.81 64.39±0.65 1.51 2.29 中剂量组 39 51 37.81±0.96 48.96±0.88 62.04±0.89 67.03±0.54** 3.87 6.01 高剂量组 42** 57** 40.33±0.93* 52.6±0.83** 64.14±0.82** 71.79±0.73** 10.80 14.01 注:*表示各剂量组与对照组相比差异显著,P<0.05;**表示各剂量组与对照组相比差异极显著,P<0.01;表5~表7同。 表 5 甲鱼肽对果蝇SOD活力的影响
Table 5 Effects of STP on SOD activity in D. melanogaster
组别 雌果蝇SOD活力(U/mg prot) 雄果蝇SOD活力(U/mg prot) 20 d 40 d 20 d 40 d 对照组 264.71 ±12.85 243.67 ± 5.90 358.33 ±5.84 328.71 ± 10.32 低剂量组 273.44 ±9.58 250.65 ± 8.77 368.35 ± 4.87 347.70 ±9.37 中剂量组 285.35 ±10.39 263.37 ± 7.64* 377.40 ± 6.97* 361.06 ± 8.39* 高剂量组 334.13 ±10.14** 312.90 ± 7.21** 383.68 ± 3.96** 378.28 ± 8.82** 表 6 甲鱼肽对果蝇MDA含量的影响
Table 6 Effects of STP on MDA content in D. melanogaster
组别 雌果蝇MDA含量(nmol/mg prot) 雄果蝇MDA含量(nmol/mg prot) 20 d 40 d 20 d 40 d 对照组 0.33 ± 0.04 0.36 ±0.01 0.25 ± 0.02 0.26 ± 0.02 低剂量组 0.30 ± 0.02 0.32 ± 0.04 0.23 ± 0.01 0.22±0.03 中剂量组 0.27 ± 0.03 0.29 ± 0.01* 0.19 ±0.02* 0.20 ± 0.01* 高剂量组 0.24 ±0.02* 0.24 ± 0.01** 0.16 ±0.03** 0.17 ± 0.01** 表 7 甲鱼肽对果蝇CAT活力的影响
Table 7 Effects of STP on CAT activity in D. melanogaster
组别 雌果蝇CAT活力(U/mg prot) 雄果蝇CAT活力(U/mg prot) 20 d 40 d 20 d 40 d 对照组 57.03 ± 3.22 63.49 ± 4.56 117.25 ± 9.19 85.33 ± 6.49 低剂量组 79.69 ± 9.54* 83.80 ± 9.81 146.01 ± 10.84 99.73 ± 3.13 中剂量组 96.47 ± 5.91** 87.39 ±4.41* 156.48 ± 7.50* 111.60 ± 6.62** 高剂量组 87.64 ± 8.70** 84.76 ± 10.45* 166.92 ± 19.08** 117.80 ± 8.99** -
[1] Anton B, Vitetta L, Cortizo F, et al. Can we delay aging? The biology and science of aging[J]. Annals of the New York Academy of ences,2010,1057(1):525−535.
[2] Ivanova D G, Yankova T M. The free radical theory of aging in search of a strategy for increasing life span[J]. Folia Medica,2013,55(1):33−41. doi: 10.2478/folmed-2013-0003
[3] Liochev S I. Reactive oxygen species and the free radical theory of aging[J]. Free Radical Biology and Medicine,2013,60(10):1−4.
[4] 张强,李伟华. 抗氧化肽的研究现状[J]. 食品与发酵工业,2021,47(2):298−304. [5] Wang W, Zhao Y, Zhao G, et al. Antioxidant peptides from collagen hydrolysate of redlip croaker (Pseudosciaena polyactis) scales: Preparation, characterization, and cytoprotective effects on H2O2-damaged HepG2 cells[J]. Marine Drugs,2020,18(3):156.
[6] 周越. 贻贝肽与贻贝多糖对衰老的干预作用及其机制[D]. 镇江: 江苏大学, 2013. [7] 杨坤. 叶瓜参提取物的酶法制备及其抗衰老活性研究[D]. 广州: 华南理工大学, 2018. [8] 章继华, 何永进. 甲鱼系列产品综合生产工艺[J]. 农牧产品开发,1999(2):26−27. [9] 屈思雨, 韦懿芳, 王丁丁, 等. 甲鱼肉蛋白酶解物的抗氧化活性研究[J]. 广东化工,2019,46(7):18−19, 4. doi: 10.3969/j.issn.1007-1865.2019.07.008 [10] Wang N, Wang W, Liu X, et al. Purification and characterization of antiproliferative peptide from enzymatic hydrolysates of Chinese soft-shelled turtle protein[J]. International Journal of Agriculture and Biology,2018,20(1):209−214.
[11] Liao P Y, Lan X D, Liao D K, et al. Isolation and characterization of Angiotensin I-Converting Enzyme (ACE) inhibitory peptides from the enzymatic hydrolysate of Carapax Trionycis (the shell of the turtle Pelodiscus sinensis)[J]. Journal of Agricultural and Food Chemistry,2018,; 66(27):7015−7022.
[12] 怀雪, 孟永海, 王艳艳, 等. 刺玫果提取物抗衰老作用的研究[J]. 食品科技,2019,44(2):215−220. [13] 朱俊向, 于丁一, 宋玉凤, 等. 动物蛋白水解酶法制备南极磷虾多肽及其抗氧化活性[J]. 中国调味品,2019,44(4):104−107. doi: 10.3969/j.issn.1000-9973.2019.04.022 [14] 丁树慧, 齐曼婷, 齐斌, 等. 低值海洋鱼低聚肽抗氧化和抗疲劳活性[J]. 食品科学,2019,40(1):163−169. [15] 吕艳. 酶解小麦蛋白制取谷氨酰胺活性肽的研究[D]. 杭州: 浙江大学, 2005. [16] 肖发. 王浆主蛋白MRJPs对果蝇的抗衰老功能及分子机理研究[D]. 杭州: 浙江大学, 2013. [17] 王耀辉, 任海虹, 王景雪, 等. 白灵菇多糖对果蝇寿命及抗氧化活性的影响[J]. 食品工业科技,2018,39(5):313−318. [18] 张明, 何超, 邵颖, 等. 蛹虫草多糖对果蝇寿命及抗氧化活性的影响[J]. 食品科技,2016,41(11):179−183. [19] 申彩红. 海参肽的酶法制备及其抗氧化、抗疲劳活性研究[D]. 厦门: 华侨大学, 2015. [20] 赵翊君. 鲈鱼鱼肉抗氧化肽的分离鉴定及其对HepG2细胞氧化损伤的保护作用研究[D]. 广州: 华南理工大学, 2018. [21] 郑晓仪. 酶解蟹腿残肉制备抗氧化肽的研究[D]. 广州: 华南理工大学, 2016. [22] Alvers A L, Fishwick L K, Wood M S, et al. Autophagy and amino acid homeostasis are required for chronological longevity in Saccharomyces cerevisiae[J]. Aging Cell,2009,8(4):353−69. doi: 10.1111/j.1474-9726.2009.00469.x
[23] D'Antona Giuseppe, Ragni Maurizio, Cardile Annalisa, et al. Branched-chain amino acid supplementation promotes survival and supports cardiac and skeletal muscle mitochondrial biogenesis in middle-aged mice[J]. Cell Metabolism,2010,12(4):362−372. doi: 10.1016/j.cmet.2010.08.016
[24] Li F, Yin Y, Tan B, et al. Leucine nutrition in animals and humans: MTOR signaling and beyond[J]. Amino Acids,2011,41(5):1185−1193. doi: 10.1007/s00726-011-0983-2
[25] 丘婷, 吴思, 陈朋, 等. 六味地黄生物制剂多糖对果蝇抗氧化作用的影响[J]. 中国实验方剂学杂志,2012,18(22):215−218. [26] 刘冀婕, 黄玲艳, 曾照准, 等. 桂花提取物对雄性果蝇抗氧化及抗衰老作用的研究[J]. 食品研究与开发,2018,39(21):45−50. [27] 赵利, 张维民, 王杉, 等. 酪蛋白非磷肽抗生物氧化活性的研究[J]. 上海交通大学学报(农业科学版),2004(2):23−27. [28] 张静静, 刘暄, 赵琦, 等. 褐变黑枸杞对紫外照射损伤果蝇寿命及抗氧化能力的影响[J]. 中国食品添加剂,2020,31(1):53−58. [29] 陈纯. 紫薯提取物对果蝇和线虫抗氧化作用的研究[D]. 天津: 天津科技大学, 2016. [30] Dai Z, Lu X Y, Zhu W L, et al. Carnosine ameliorates age-related dementia via improving mitochondrial dysfunction in SAMP8 mice[J]. Food & Function,2020:11.
[31] Xin X X, Chen Y, Chen D, et al. Supplementation with Major royal-jelly proteins increases lifespan, feeding, and fecundity in drosophila[J]. Journal of Agricultural & Food Chemistry,2016,64(29):5803.
[32] Shen L R, Xiao F, Yuan P, et al. Curcumin-supplemented diets increase superoxide dismutase activity and mean lifespan in drosophila[J]. Age,2013,35(4):1133−1142. doi: 10.1007/s11357-012-9438-2
[33] 张碧莹, 钱籽霖, 唐玲, 等. 甘薯汁对果蝇寿命及抗氧化能力的影响[J]. 食品科学,2019,40(5):205−209. [34] 黄杰, 王华丽, 马娜, 等. 迷迭香提取物抗氧化作用及其对果蝇寿命的影响[J]. 中国食品学报,2016,16(5):19−24.





 下载:
下载:

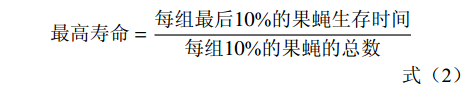
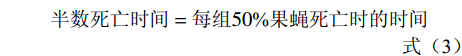
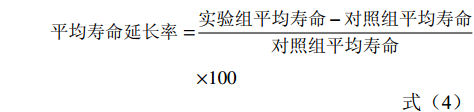
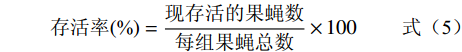
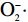
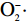
 下载:
下载:
