Study on the Effect of Blackbean Polypeptide on Hepatocyte Injury in Mice with Overload Training
-
摘要: 为探究黑豆多肽对超负荷运动小鼠肝脏细胞的保护机制,实验以黑豆为原料采用酶解法联合超滤萃取法制取了分子量区间分别为<3、3~5、5~10 kDa的黑豆多肽,以上述黑豆多肽饲喂小鼠并建立超负荷运动模型,以探究不同分子量区间黑豆多肽对运动性肝细胞损伤的保护作用。结果显示:经超负荷训练后模型组小鼠肝功能出现异常,表现为肝指数水平上升,血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)活性下降,而饲喂黑豆多肽的剂量组肝功能得到了不同程度缓解;实验进一步对肝脏组织T-SOD、GSH-Px酶活测定的数据分析得出,黑豆多肽通过提高抗氧化物酶的活性从而降低机体氧化应激水平,达到抗过氧化损伤的功效并表现为MDA含量显著下降;为明晰黑豆多肽对小鼠肝脏细胞的保护机制,对血清中TNF-α含量以及NF-κB相对表达量进行了测定,其中分子量<3 kDa能够显著降低血清TNF-α的分泌以及NF-κB的相对表达量。结论:黑豆多肽能够有效缓解由超负荷运动导致的肝脏功能异常,并提高抗氧化物酶活性,减弱肝脏氧化应激水平,降低TNF-α的释放以及NF-κB的表达,从而防止由过氧化损伤致使细胞膜裂变而引起的肝细胞损伤。Abstract: In order to explore the protective mechanism of black bean peptide on hepatocyte injury induced by overload exercise in mice, black bean protein isolate was prepared from black bean. The peptides were prepared by enzymolysis and ultrafiltration with molecular weight ranged<3, 3~5 and 5~10 kDa. The model of liver injury induced by overload exercise in mice was established to study the effect of different molecular weight ranges on liver protection. The results showed that: After overload training, the liver function of the model group was abnormal, which showed that an increase in level of liver index and decrease in levels of serum ALT and AST. The liver function of mice fed with black bean polypeptide was improved in different degrees. Analysis of the data of liver tissue T-SOD, GSH-Px enzyme activity showed that black soybean polypeptide can reduce the level of oxidative stress by increasing the activity of antioxidant enzyme, and achieve the effect of anti-peroxidation damage, and the content of MDA was significantly decreased. In order to clarify the protective mechanism of black bean polypeptide on mouse liver cells, the serum TNF-α content and the relative expression of NF-κB were determined. The results showed that the serum TNF-α secretion and the relative expression of NF-κB were significantly decreased when the molecular weight of blackbean polypeptide was less than 3 kDa. In conclusion, black soybean polypeptide can effectively alleviate the abnormal liver function caused by overload exercise, increase the activity of antioxidant enzymes, reduce the level of oxidative stress, reduce the release of TNF-α and the expression of NF-κB, so as to prevent hepatocyte damage caused by cell membrane fission caused by peroxidation damage.
-
Keywords:
- black bean polypeptide /
- hepatocyte injury /
- antioxidant /
- inflammatory factors
-
超负荷运动训练在竞技体育运动员的日常训练中必不可少,但不适宜的超负荷运动会导致机体出现严重的过度训练综合征,它在竞技体育运动员中是一种常见的运动性劳损,运动员为提高运动成绩采用“超负荷训练”后,若没有及时的休息与恢复就会引发该症状[1-2]。研究表明运动的强度与肝细胞的凋亡有着密切联系,高强度运动会使肝细胞缺氧,抗氧化物酶逐渐消耗、活性降低,致使机体无法完全代谢氧自由基,进而肝脏氧自由基水平升高[2],而自由基的蓄积会使肝细胞结构异常、细胞膜通透性提高、内容物溢出等[3-4]。肝脏是机体重要的代谢、排毒器官,大多数物质需要经过肝脏代谢才能通过循环系统排出体外。肝脏受到损伤时会诱发肝细胞凋亡、坏死等特征的疾病,其机理主要来源于自由基生物学理论与线粒体损伤、自由基脂质过氧化、炎症细胞因子分泌和细胞膜损伤[5-6]。因而,适当补充具有清除自由基的外源活性抗氧化物质,能够有效抵御高强度运动代谢生成氧自由基造成的过氧化损伤,从而保护肝细胞。
黑豆别名乌豆,是黑色种皮的豆科植物。黑豆中的蛋白质具有多种生物学活性,如抗氧化、抗疲劳、延缓衰老等[7]。研究表明蛋白质的生物学活性基于其蛋白质原始序列中肽段的活性,但在蛋白被水解前该活性不显现[8]。目前生物酶解技术是能够最大限度保留活性肽营养价值的处理手段,能够释放或定向改造食物中的活性肽[9],将其添加到功能性食品的配方中能够有效防止与人体氧化应激相关的损伤与疾病[7]。目前,国内外对于食源性活性肽类产品的研究多集中于体外抗氧化的评估,少部分关于体内抗氧化、抗疲劳方向的研究。研究发现水解后的蛋白肽抗氧化活性提高,分子量越小抗氧化活性越强、更易被人体所吸收[10],并能够通过抑制肌肉和肝脏内由脂质过氧化产物蓄积而引起的细胞损伤[11-12]。戚颖欣等[13]研究发现,大豆多肽能够通过降低机体氧化应激水平对急性肝损伤产生保护作用。樊迎等[14]等研究发现,水解小黑豆乳清蛋白能够使急性肝损伤模型小鼠血清中ALT、AST活性降低,达到保护肝细胞的作用;目前对于黑豆多肽的体内抗氧化活性已有一些相关研究,但对于不同分子量区间黑豆多肽对运动性肝细胞损伤保护的研究较为稀缺。
本实验拟采用黑豆为原料制备不同分子量区间的黑豆多肽,在此基础上采用力竭游泳建立超负荷训练疲劳小鼠模型并饲喂黑豆多肽,以肝脏系数、血清中丙氨酸氨基转移酶、天门冬氨酸氨基转移酶评判所制黑豆多肽对肝脏保护作用的影响,并测定肝脏抗氧化物酶活性评价机体氧化应激水平,最终通过血清TNF-α含量与NF-κB的相对表达量,对黑豆多肽的抗运动性肝损伤进行综合评估,为开发具有抗运动性肝损伤类保健品的研制提供理论参考。
1. 材料与方法
1.1 材料与仪器
选取个体质量约(20±2.0) g的SPF级昆明种雄性健康小鼠 50只,购自黑龙江中医药大学SYXK(黑)2016-004,饲养期间给予啮齿类动物标准颗粒饲料及自由饮水,饲养环境恒定湿度55%,室温(25±1) ℃,自由进食一周后应用于实验研究;东北黑豆 市购;PLBC07610millipore超滤膜-3 kDa/5 kDa/10 kDa、8050型超滤杯 默克密理博公司;生化指标检测试剂盒、ELISA酶联免疫试剂盒、NF-κB p65羊抗兔单抗、辣根过氧化物酶标记羊抗鼠 碧云天生物技术公司;Lowry蛋白质试剂盒、SDS-PAGE凝胶制备试剂盒、彩虹180广谱蛋白Marker 索莱宝科技有限公司;其他所用试剂 为分析纯。
BHS-2型恒温水浴锅 宁波市鄞州群安实验仪器有限公司;FC酶标仪 美国赛默飞世尔科技公司;磁力搅拌器 德国IKA公司;UV-2600型紫外可见分光光度计 日本岛津公司;垂直电泳转印系统、GelDoc EZ凝胶成像仪 伯乐生命医学产品有限公司;恒温游泳箱 北京智鼠多宝生物科技有限责任公司。
1.2 实验方法
1.2.1 黑豆多肽的制备
黑豆分离蛋白参考高岩松[15]的方法稍加修改,将黑豆研磨后过60目筛网得到黑豆粉,用1:10(M:V)正己烷脱脂三次后与蒸馏水以1:20(M:V)的比例混合,用2 mol/L的NaOH将溶液pH值调至9.0,在4 ℃条件下8000 r/min离心20 min去除不溶杂质。将溶液用2 mol/L的HCl将溶液pH调至4.5将蛋白质沉淀,反复离心水洗蛋白后,将溶液pH调至7.0,于−20 ℃预冻12 h后冷冻干燥处理后得到黑豆分离蛋白。配制黑豆分离蛋白质量浓度约5%的溶液并加入0.2%的Alcalase碱性蛋白酶(24000 U/g),在55 ℃下酶解3 h,灭酶后在4 ℃条件下8000 r/min离心20 min取上清液,经超滤后分别将<3 kDa(F1组),3~5 kDa(F2组),5~10 kDa(F3组)的黑豆多肽冷冻干燥后于密封袋中−20 ℃保存。
1.2.2 动物建模、分组及给药
动物模型的建立参考文献[16],将50只健康雄性小鼠随机分为5组,设立对照组、模型组、F1组(<3 kDa)、F2组(3~5 kDa)、F3组(5~10 kDa)。采用灌胃法给予样品容量均0.2 mL/d,设置剂量组100 mg/kg·bw·d(高剂量),模型组、对照组给予等量生理盐水。对模型组、F1组、F2组、F3组采用力竭游泳训练建立超负荷训练模型,游泳箱温度设置为(25±1) ℃,实验开始前适应性游泳训练3 d,随后每隔一天进行一次力竭训练游泳,总实验周期为21 d。当小鼠完全下沉至水面下超过10 s且捞出后无法完成翻正反射,即为力竭。末次力竭运动实验后,小鼠断颈处死后摘取眼球取血。
1.2.3 体质量和肝脏指数的测定
小鼠体质量称重实施于第一次力竭训练进以及末次训练进食前,肝脏指数计算按如下公式:
肝脏指数(mg·g−1)=肝湿重/体质量×100
1.2.4 血清TNF-α、ALT、AST的测定
将采集到的新鲜血液于4 ℃静置1 h后,在3000 r/min条件下分离15 min制取血清。严格遵照试剂盒使用说明测定血清中的肿瘤坏死因子(TNF-α)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)。
1.2.5 肝脏T-SOD、GSH-Px、MDA的测定
将采血后的小鼠解剖摘取肝脏并称重,用生理盐水处理后捣碎处理成10%组织匀浆,用以测定总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)含量,剩余样本保存于−70 ℃超低温冰箱中备用。
1.2.6 肝脏NF-κB的测定
1.2.6.1 肝脏蛋白的提取
将肝脏组织搅碎后用并PBS缓冲液清洗,在500 r/min条件下分离3 min弃上清液,向各组样品中加入200 μL的1% PMSF、RIPA,400 W超声裂解10 s,约3~4次后在14000 r/min条件下分离10 min保留上清液。蛋白质浓度的测定采用索莱宝Lowry试剂盒。
1.2.6.2 Western Blot法
胶片的制备参考试剂盒说明,上样体积5 μL,分离电压恒定70 V。转膜前将胶片置入甲醇中活化5 min后放入上样缓冲液中平衡10 min,转膜电压100 V,时间约2 h。转膜后将聚偏二氟乙烯(Polyvinylidene fluoride, PVDF)胶片放入TBST中摇洗10 min,随后置入封闭液中摇床孵育2 h。一抗采用1:1000兔抗鼠单抗于摇床孵育12 h以上,二抗采用1:500羊抗兔二抗摇床孵育2 h。最后将PVDF进行ECL发光,根据曝光效果选取最佳图片。以兔抗鼠β-actin抗体为内参,通过Image J图像分析软件通过灰度计算NF-κB的相对表达量[11]。
1.3 数据处理
应用SPSS 19.0软件对数据进行。实验数据以均值±标准偏差(Mean±SD)表示,样本间比较采用T-Test,P<0.05为差异显著,P<0.01为差异极显著。采用Origin 2017软件进行图表处理及图谱分析处理。
2. 结果与分析
2.1 体质量与肝脏指数
由表1可知小鼠体质量在造模前后组间均无显著差异,这是由于小鼠体质量主要随着喂养时间的增加而逐渐提升,因而在相同环境与饲喂条件下并无差异。
表 1 小鼠的体质量变化及肝指数Table 1. Effect on body mass and liver index in mice肝指数实验结果显示,模型组小鼠的肝指数极显著高于对照组(P<0.01),F3组未能改善力竭超负荷训练小鼠的肝指数(P>0.05),而F1组与F2组均能够使小鼠的肝指数极显著降低(P<0.01)。肝指数是较直观衡量肝功能的评测指标,当肝脏出现损伤时会出现肥大、水肿、充血等异常现象,导致肝指数水平上升[17-18]。
2.2 血清ALT与AST活性
ALT与AST实验结果见表2,在本实验中模型组与对照组相比血清ALT和AST水平极显著增加(P<0.01),表明该力竭训练模型下可致使小鼠肝功能受损。ALT分析:F3组未能使ALT含量与模型组出现差异,而F2与F1组均能使ALT活性极显著降低(P<0.01),且F1能够使ALT水平恢复到对照组水平。AST分析:与模型组相比,F3组未能使AST活性得到改善,F1组能够使AST活性极显著降低(P<0.01),F2显著降低(P<0.05)。血清ALT和AST水平常被用于评判肝功能是否发生异常,ALT和AST在血清中含量极低,而当肝脏受到刺激导致功能异常时,便会向血液中释放ALT和AST[19]。吴严冰[20]在小鼠力竭游泳实验以及李志强[21]等在小鼠急性肝损伤实验中均发现,当小鼠肝脏受损时血清ALT和AST在力竭游泳后升高,对急性肝损伤小鼠实验中饲喂小黑豆乳清蛋白后血清ALT、AST活力下降与本文结果一致[14]。
表 2 小鼠血清生化指标Table 2. Serum biochemical indexes of mice组别 ALT(U·mL−1) AST(U·mL−1) 对照组 81.76±14.79 78.11±12.97 模型组 148.23±12.36△△ 190.25±16.77△△ F1 93.09±11.50** 92.52±13.80△** F2 106.45±10.93△△** 167.79±10.85△△* F3 134.76±16.87△△ 180.04±16.05△△ 2.3 小鼠肝脏生化指标
肝脏是机体重要的代谢器官,能够将各种内、外源性非营养物质转化,但极易受到生物毒素如活性氧自由基的损伤,活性氧自由基会诱使生物膜发生脂质过氧化反应,导致细胞膜上磷脂降解,破坏细胞膜结构、增大细胞膜通透性,致使肝细胞坏死[22-23]。实验中,小鼠在进行超负荷运动后能耗需求增加,氧化代谢速度加快使体内蓄积大量活性氧自由基,由于器官、组织中的活性氧自由基的直接测定比较困难,通过测定相应抗氧化物酶活性能够间接反应机体的氧化应激水平。黑豆多肽对小鼠肝脏生化指标实验结果见表3。
表 3 小鼠肝脏生化指标Table 3. Biochemical indexes of mouse liver组别 T-SOD(U·mg−1) GSH-Px(U·mg−1) MDA(nmol·g−1) 对照组 131.97±6.18 6.59+0.25 2.86±0.16 模型组 84.38±5.13△△ 3.48+0.33△△ 5.32±0.27△△ F1 112.94±9.21△△** 5.40+0.28△△** 4.56±0.24△△** F2 100.19±11.53△△** 4.49+0.30△△** 4.65±0.22△△** F3 88.55±8.04△△ 3.97+0.25△△** 4.94±0.23△△** 在本实验中,超负荷训练使四组小鼠T-SOD、GSH-Px、MDA含量均与对照组差异极显著(P<0.01)。T-SOD分析:F3组未能使T-SOD活性与模型组出现统计学差异(P>0.05),而F1和F2组与模型组相比均能极显著提高T-SOD活性(P<0.01),分别提高了33.85%、18.73%。GSH-Px分析:F1、F2、F3三组黑豆多肽均能够使小鼠肝脏GSH-Px活性极显著提高(P<0.01),其中F1效果最佳,提升了55.17%,但仍与对照组活性有极显著差异(P<0.01)。MDA分析:F1、F2、F3三剂量组小鼠肝脏中MDA的含量极显著低于模型组(P<0.01),其中F1组脂质抗过氧化能力最强,MDA含量最低约降低了14.29%。
SOD与GSH-Px都是参与机体抗氧化反应的关键酶。SOD酶是活性氧自由基的唯一底酶,能够通过歧化反应将超氧阴离子自由基转化为H2O2和O2,降低自由基在机体内的累积,从而保护机体免受活性氧自由基的攻击[24]。GSH-Px主要通过分解体内的H2O2和其他氢过氧化物,从而防止组织和细胞免受氧化应激的影响[25]。MDA是细胞膜中不饱和脂肪酸受到过剩氧自由基攻击,从而发生脂质过氧化损伤的的终产物,它是评价机体氧化应激水平的重要标志物[26]。在该运动性肝损伤模型下,抗氧化物酶活性降低,这可能是由于有氧运动过程中随着自由基的不断生成抗氧化物酶如SOD、GSH-Px等逐渐被消耗,进而使自由基生成速率大于清除速率,表现为脂质过氧化终产物MDA的大量蓄积,进而演变为自由基导致的肝脏细胞凋亡[27]。在喂饲不同分子量区间的黑豆多肽后,不同程度上提高了抗氧化物酶的活性,相应降低了肝脏的氧化应激水平从而保护了肝脏细胞,相应反馈为MDA产量降低,其中F1组效果最佳。李明亮等[28]等在小鼠的抗疲劳实验中发现,喂饲大豆肽和小麦肽能够提高T-SOD、GSH-Px的酶活性,降低MDA的蓄积从而提高机体抗氧化能力,与本文实验结果相佐。
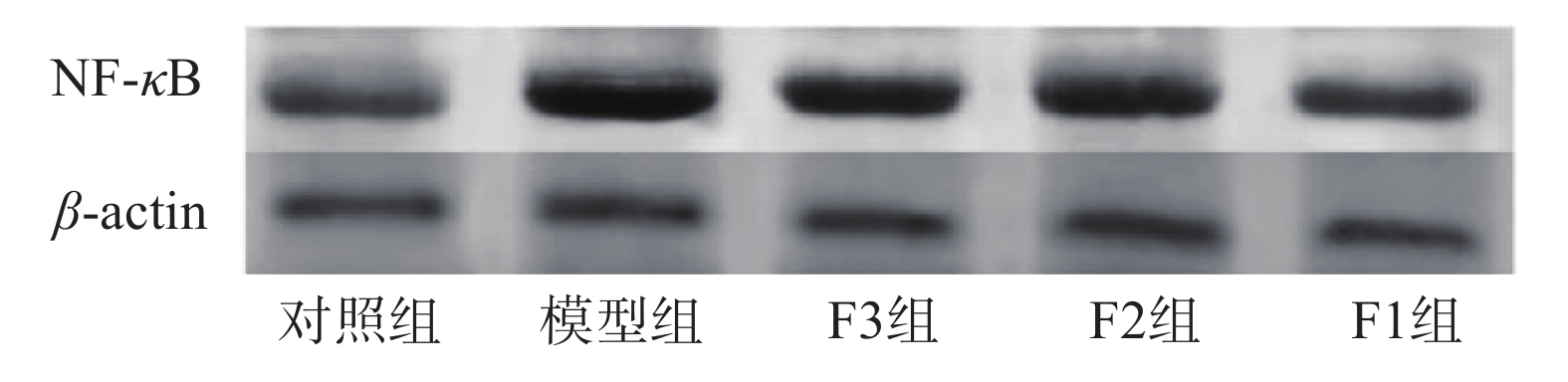
2.4 肝组织TNF-α含量与NF-κB的相对表达量
血清TNF-α含量与NF-κB的相对表达量见表4和图1,结果显示模型组TNF-α水平极显著高于对照组(P<0.01),F2、F3组未能显著降低血清TNF-α水平(P>0.05),而F1组能够使TNF-α水平显著降低(P<0.01)。NF-κB表达水平经图像分析处理结果表明,模型组NF-κB相对表达水平极显著高于对照组(P<0.01),F3组可以显著降低NF-κB相对表达水平(P<0.05),F2、F1组均能极显著降低NF-κB相对表达水平(P<0.01)。
表 4 TNF-α含量与NF-κB的相对表达量Table 4. TNF-α content and relative expression of NF-κB组别 TNF-α(pg·mL−1) NF-κB 对照组 132.41±14.07 1.02±0.02 模型组 188.90±9.85△△ 1.72±0.07△△ F1 152.70±12.22△* 1.21±0.07△** F2 172.65±17.06△△ 1.37±0.07△△** F3 180.42±16.73△△ 1.48±0.05△△* TNF-α是一种关键细胞因子能够加速炎症反应并参与机体的免疫调节[29],它由巨噬细胞产生,在低浓度时对细胞具有保护作用,但浓度过量会诱使机体出现炎症反应综合征,肝脏是其重要的靶器官。NF-κB是TNF-α炎症级联反应中的重要细胞因子,它不需要新蛋白质合成就能被激活的初级转录因子,被认为是有害细胞刺激的第一反应者,其二者含量在运动性肝损伤模型中具有重要意义[30-31]。从饲喂黑豆多肽的结果分析,黑豆多肽能够有效控制作为炎症反应启动因子TNF-α在血清中的分泌,并能够在肝脏中抑制NF-κB通路的表达控制肝细胞的炎症反应,达到保护肝脏细胞的目的,与罗安玲[32]在酒精肝损伤小鼠模型中实验结果一致。
3. 讨论与结论
采用了生物酶解联合超滤法制备了分子量区间为<3、3~5、5~10 kDa的黑豆多肽,通过力竭游泳超负荷训练小鼠模型可以发现,黑豆多肽对小鼠肝细胞能够起到一定保护作用,其中分子量<3 kDa的黑豆多肽对超负荷训练肝损伤小鼠的肝细胞保护作用最佳,在该剂量组下,小鼠的肝指数、血清ALT、AST水平以及肝脏组织中MDA含量显著降低,肝组织中T-SOD、GSH-Px活性显著提升,通过TNF-α水平以及NF-κB相对表达水平的降低,进一步验证黑豆多肽能通过抑制炎症通路的表达保护肝脏细胞。综上可以得出以下结论,黑豆多肽对肝细胞的保护作用强度与分子量大小负相关,分子量较低(<3 kDa)的黑豆多肽具有更强的体内抗氧化活性、更强的自由基清除能力,从而能够更有效抑制脂质过氧化产物在机体内的蓄积,一定程度上防止或缓解脂质过氧化损伤,并且能够一定程度上抑制炎症反应的通路起到防止细胞损伤的作用。
目前我国对于肽类产品的应用已有较完善的国家标准(GB24154-2015),本实验所制备黑豆蛋白肽不但适用于中、高强度运动后恢复类蛋白肽类产品的研发,也可以用作复合抗氧化产品的壁材、辅料,并能够为黑豆蛋白肽与其他具有抗氧化、抗肝细胞损伤的生物活性物质间的协同作用的研究提供参考。
-
表 1 小鼠的体质量变化及肝指数
Table 1 Effect on body mass and liver index in mice
表 2 小鼠血清生化指标
Table 2 Serum biochemical indexes of mice
组别 ALT(U·mL−1) AST(U·mL−1) 对照组 81.76±14.79 78.11±12.97 模型组 148.23±12.36△△ 190.25±16.77△△ F1 93.09±11.50** 92.52±13.80△** F2 106.45±10.93△△** 167.79±10.85△△* F3 134.76±16.87△△ 180.04±16.05△△ 表 3 小鼠肝脏生化指标
Table 3 Biochemical indexes of mouse liver
组别 T-SOD(U·mg−1) GSH-Px(U·mg−1) MDA(nmol·g−1) 对照组 131.97±6.18 6.59+0.25 2.86±0.16 模型组 84.38±5.13△△ 3.48+0.33△△ 5.32±0.27△△ F1 112.94±9.21△△** 5.40+0.28△△** 4.56±0.24△△** F2 100.19±11.53△△** 4.49+0.30△△** 4.65±0.22△△** F3 88.55±8.04△△ 3.97+0.25△△** 4.94±0.23△△** 表 4 TNF-α含量与NF-κB的相对表达量
Table 4 TNF-α content and relative expression of NF-κB
组别 TNF-α(pg·mL−1) NF-κB 对照组 132.41±14.07 1.02±0.02 模型组 188.90±9.85△△ 1.72±0.07△△ F1 152.70±12.22△* 1.21±0.07△** F2 172.65±17.06△△ 1.37±0.07△△** F3 180.42±16.73△△ 1.48±0.05△△* -
[1] 范晓峰. 长期超负荷运动下人体特征部位损伤概率实验分析预测[J]. 周口师范学院学报,2019,36(5):112−116. [2] 康杰, 张馨匀, 陈禄水. 大强度运动对肝细胞凋亡的影响及其机制的研究进展[J]. 辽宁体育科技,2012,34(4):30−32. doi: 10.3969/j.issn.1007-6204.2012.04.010 [3] Kress V, Bittner A, Kopp M, et al. Effect of short-term low-intensity exercise training on association of oxygen free radicals and nitric oxide production in patients with acute myocardial infarction.[J]. International Journal of Angiology Official Publication of the International College of Angiology Inc,2013,22(3):159−164.
[4] 刘志二, 赵大林, 李进华, 等. 人参茎叶提取物对过度训练大鼠肝组织氧化损伤的预防作用[J]. 沈阳体育学院学报,2009(5):65−67, 76. [5] Cai W, Wu J, Hong L, et al. Oxidative injury and hepatocyte apoptosis in total parenteralnutritionassociated liver dysfunction[J]. Journal of Pediatric Surgery,2006,41(10):1663−1668. doi: 10.1016/j.jpedsurg.2006.05.067
[6] 黄松, 彭胜亮, 卢强, 等. 芍药苷预处理对肝缺血再灌注大鼠肝功能及线粒体损伤的影响[J]. 检验医学与临床,2020,17(9):1177−1179. [7] 高洋, 于栋. 黑豆多肽的研究现状[J]. 粮食流通技术,2017,8(16):20−22. [8] Sonklin C, Laohakunjit N, Kerdchoechuen O. Assessment of antioxidant properties of membrane ultrafiltration peptides from mungbean meal protein hydrolysates[J]. Peerj,2018,6(7):e5337.
[9] He R, Malomo S A, Alashi A, et al. Purification and hypotensive activity of rapeseed protein-derived renin and angiotensin converting enzyme inhibitory peptides[J]. Journal of Functional Foods,2013,5(2):781−789. doi: 10.1016/j.jff.2013.01.024
[10] 强婉丽, 李静, 郇美丽, 等. 大豆肽、小麦肽、胶原肽在运动营养领域的研究进展[J]. 粮油食品科技,2020,28(4):59−65. [11] Zheng Z, Yang X, Liu J, et al. Effects of wheat peptidesupplementation on anti-fatigue and immunoregulation duringincremental swimming exercise in rats[J]. RSC Advances,2017,7(69):43345−43355. doi: 10.1039/C7RA07860A
[12] Khairallah R J, O’Shea Karen M, Ward C W, et al. Chronic dietary supplementation with soy protein improves muscle function in rats[J]. Plos One,2017,12(12):e0189246. doi: 10.1371/journal.pone.0189246
[13] 戚颖欣, 孟军, 曹柏营, 等. 大豆多肽对小鼠急性肝损伤保护作用的研究[J]. 食品科学,2009(21):372−374. [14] 樊迎, 王常青, 王菲, 等. 小黑豆乳清蛋白和水解多肽对小鼠急性肝损伤的保护作用[J]. 食品科学,2013(5):246−249. [15] 高岩松. 黑豆多肽-蓝莓复合饮料研制及抗氧化活性的研究[D]. 吉林: 吉林农业大学, 2019. [16] 黎健民. 黄精多糖对力竭训练小鼠肝组织损伤的保护作用[J]. 基因组学与应用生物学,2016,35(5):1036−1041. [17] 程旭光, 张晓玲, 周薇等. 大鼠过度疲劳模型的建立及过度训练对肝、肾结构的影响[C]// 全国体育科学大会. [18] 金山虎, 袁海燕, 胡亚哲. 不同强度游泳运动对大鼠肝脏形态结构和细胞凋亡的影响[J]. 华南国防医学杂志,2018,32(3):153−156. [19] 李元慈. 茶多酚对肝脏的保护作用研究[J]. 中国食物与营养,2019,25(9):75−78. doi: 10.3969/j.issn.1006-9577.2019.09.017 [20] 吴严冰. 白藜芦醇对力竭运动小鼠肝损伤的保护作用[J]. 世界华人消化杂志,2015,23(19):3117−3122. [21] 李志强, 周红秋, 欧阳臻,等. 不同种植模式的霍山石斛对小鼠急性肝损伤的保护作用[J]. 中成药,2020,42(5):1155−1162. doi: 10.3969/j.issn.1001-1528.2020.05.010 [22] 张辉. 女贞子提取物对大强度耐力训练力竭后大鼠肝组织自由基代谢的影响[J]. 中国老年学杂志,2018,38(6):1479−1481. doi: 10.3969/j.issn.1005-9202.2018.06.082 [23] 梁馨之. 黑色食品活性物质的分离纯化及功能研究[D]. 吉林: 吉林大学, 2020. [24] 朱秀敏. 超氧化物歧化酶的生理活性[J]. 当代医学,2011,17(15):26−27. doi: 10.3969/j.issn.1009-4393.2011.15.017 [25] 汤小朋, 陈磊, 熊康宁等. 硒蛋白—哺乳动物谷胱甘肽过氧化物酶家族研究进展[J]. 生命的化学,2019(6). [26] 闫雅男. 递增负荷运动血液乳酸与丙二醛时相性变化的人体研究[D]. 石家庄: 河北师范大学, 2016. [27] Yang W S, Stockwell B R. Ferroptosis: Death by Lipid Peroxidation[J]. Trends in Cell Biology, 26(3), 165–176.
[28] 李明亮, 尹曼, 凌空, 等. 大豆肽和小麦肽抗疲劳功能的实验研究[J]. 食品科技,2019,44(9):303−307. [29] Anna Csiszar, Kira Smith, Nazar Labinskyy. Resveratrol attenuates TNF-α-induced activation of coronary arterial endothelial cells: role of NF-κBinhibition[J]. Journal of Biochemistry,2015,123(4):680.
[30] LueddeT, Schwabe R F. NF-κB in the liver—linking injury, fibrosis and hepatocellular carcinoma[J]. Nature Reviews Gastroenterology & Hepatology,2011,8(2):108−18.
[31] Vincent Lagente, Tatiana Victoni, Elisabeth Boichot. Matrix metalloproteinase inhibitors as new anti-inflammatory drugs[M]// Proteases and Their Receptors in Inflammation. Springer Basel, 2011.
[32] 罗安玲, 陈心馨, 郑有丽, 等. 葛根、藤茶、玉米低聚肽复合组方对小鼠慢性酒精性肝损伤的保护作用[J]. 现代食品科技,2019,35(6):70−76, 69.





 下载:
下载:
 下载:
下载:
