Optimization of Enzymatic Hydrolysis of Hongdao Clam and Anti-hypertensive Activity of the Resulted Products
-
摘要: 以营养价值较高且具地域性特色的红岛蛤蜊为研究对象,以水解度为指标,比较了复合蛋白酶、风味蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶对蛤蜊肉的酶解效果。结果表明,复合蛋白酶的酶解效果优于其他蛋白酶。选用复合蛋白酶,通过酶解温度、pH、料液比、加酶量、酶解时间的单因素实验以及正交试验确定蛤蜊肉酶解的最佳工艺条件为:酶解温度58 ℃、酶解时间6 h、初始pH7.0、料液比1:2(g:g)、加酶量1000 U/g,在此条件下的水解度达71.03% ± 0.69%。通过高效液相测定蛤蜊肽的分子量分布,得出相对分子质量小于1000 Da的占比为94.29%。对蛤蜊肽进行降血压活性研究,结果显现了良好的血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制活性,其IC50=0.67 mg/mL。本研究结果为红岛蛤蜊的精深加工和利用提供了理论依据。Abstract: Hongdao clam with high nutritional value and regional characteristics was taken as the research object, and the enzymolysis effect of five enzymes on the clam was compared including protamex protease, flavor protease, neutral protease, alkaline protease and papain protease, using the degree of hydrolysis (DH) as the index. The results showed that the enzymolysis effect of protamex protease was better than other proteases. The effects of enzymolysis temperature, pH, material liquid ratio, enzyme dosage and enzymolysis time on the enzymatic hydrolysis were compared. Then the optimum process parameters determined by orthogonal test were as follows: enzymolysis temperature 58 ℃, enzymolysis time 6 h, initial pH7.0, material liquid ratio 1:2 (g:g) and 1000 U/g protamex, under the optimized hydrolysis conditions, the degree of hydrolysis was up to 71.03%±0.69%. The molecular weight distribution of the clam peptide was determined by high-performance liquid chromatography (HPLC) and the ratio of polypeptide molecular weight less than 1000 Da was 94.29%. The anti-hypertensive activity of clam peptide was also studied, and the results showed that the clam peptide prepared by this method had significant angiotensin converting enzyme (ACE) inhibitory activity with IC50 = 0.67 mg/mL. The results of this study provide a theoretical basis for the further processing and utilization of Hongdao clams.
-
蛤蜊肉的特点是高蛋白、高微量元素、高钙、高铁、低脂肪、低糖[1-2]。红岛蛤蜊(Ruditapes philippinarum)是青岛地区极具地域特色的蛤蜊品种,除有一般蛤蜊的营养特点外,还具有皮薄、肉嫩、出肉率高的特点,并且富含优质氨基酸和丰富的寡糖[3-4]。目前人们对蛤蜊肉主要是以鲜食为主,精深加工的蛤蜊产品较少,不仅不能满足市民对蛤蜊新产品的需求,而且蛤蜊资源没有得到充分利用,阻碍了蛤蜊产业化进程[5]。因此,如何将高蛋白的蛤蜊资源高值化利用,对于蛤蜊产业的发展具有重要意义。
伴随着近年来海洋科技的兴起,酶工业技术在水产品中的应用越来越广泛,利用蛋白酶制剂将水产品中的大分子蛋白水解为易吸收的小分子多肽,在食品行业中的优势逐渐凸显[6]。这类小分子活性肽通常还具有降血压、降血脂、预防糖尿病、抗氧化及增强免疫力的作用[7-11]。然而酶解底物的种类及来源、酶制剂选择以及酶解工艺不同都影响着酶解效果、产物的生物活性。如朱俊向等[12]通过动物蛋白水解酶制备南极磷虾多肽,优化的工艺条件为50 ℃、pH8.0、加酶量2000 U/g、酶解3 h,得到的产物具有一定抗氧化能力,可清除羟自由基和还原铁离子。陈启航等[13]采用木瓜蛋白酶对金枪鱼进行酶解,在56 ℃、加酶量300 U/g、酶解4 h的条件下可得到的金枪鱼调味汁色香味俱佳。曹文红等[14]优化的牡蛎肽酶解工艺为风味蛋白酶加酶量5000 U/g、pH6.5、酶解5 h,此工艺下的酶解产物分子量小于1000 Da的占比为43.13%。目前海洋源肽的制备主要以南极磷虾、牡蛎、海参、鲍鱼等高值水产品为原料,而有关经济水产品蛤蜊酶解制备多肽的报道较少。此外,据相关蛤蜊肽研究报道[1, 4-5],目前研究主要集中在酶解工艺的优化,鲜有对蛤蜊肽的相对分子量分布及降血压活性的报道。
本研究以红岛蛤蜊为原料,以水解度为指标,首先筛选出适宜于红岛蛤蜊水解蛋白酶,通过单因素和正交试验对酶解工艺进行优化,得到富含小分子多肽的蛤蜊肽粉。并对肽粉相对分子量分布和ACE抑制率进行测定,研究其降血压功能,为蛤蜊肉的精深加工和高值化利用提供实验依据。
1. 材料与方法
1.1 材料与仪器
新鲜红岛蛤蜊 青岛城阳区西大洋社区市场;复合蛋白酶 40万U/g、中性蛋白酶 30万U/g、风味蛋白酶 10万U/g 沧州夏盛酶生物技术有限公司;碱性蛋白酶 40万U/g、木瓜蛋白酶 100万U/g 武汉秉德生物科技有限公司;硫酸铜、硫酸钾、硼酸、氢氧化钠、盐酸 分析纯,国药集团;甲醇、乙腈 色谱纯,北京沃凯生物科技有限公司;血管紧张素转化酶 0.1 U 美国Sigma公司。
bamix GASTRO 200/PRO-3匀质机 瑞士Bamix公司;L550离心机 湘仪离心仪器有限公司;752型紫外可见分光光度计 上海舜宇恒平科学仪器有限公司;JJ-1A数显精密增力电动搅拌器 上海双捷实验设备有限公司;SKD-100凯氏定氮仪 上海市沛欧分析仪器有限公司;Agilent LC1260液相色谱仪 美国安捷伦公司;InertSustain AQ-C18色谱柱 日本岛津公司;TSK gel G2000 SWXL 色谱柱 日本东曹株式会社。
1.2 实验方法
1.2.1 原料预处理
将新鲜蛤蜊开壳取肉后用纯水清洗干净,沥水后分装,置−20 ℃冰箱保存。
1.2.2 红岛蛤蜊肉酶解工艺
参照冯金晓等[4]的工艺略有修改。称取一定量的蛤蜊肉原料,匀浆后按设定的料液比加入纯水,用1 mol/L NaOH溶液和1 mol/L HCl溶液调节最适的pH,然后加入适量的酶制剂,置于恒温水浴锅中搅拌酶解。酶解4 h后,沸水浴灭酶10 min,冰水冷却后4000 r/min离心30 min,取上清液,得蛤蜊肽酶解液。
1.2.3 红岛蛤蜊肉营养成分的测定
水分含量的测定:直接干燥法[15];总蛋白含量测定:凯氏定氮法[15];灰分测定:高温灼烧法[15];粗脂肪测定:索氏抽提法[15];氨基酸态氮含量测定:中性甲醛电位滴定法[15];总糖测定:苯酚硫酸法[16]。
1.2.4 蛋白酶制剂筛选与单因素实验
1.2.4.1 蛋白酶制剂的筛选
称取200 g蛤蜊肉,匀浆,按料液比1:1加入纯水。选取了5种蛋白酶制剂:复合蛋白酶、风味蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶。在加酶量1000 U/g以及各酶的建议pH和温度下水解2 h,具体酶解条件见表1。以水解度为指标,选出红岛蛤蜊肉酶解的最佳蛋白酶。
表 1 不同蛋白酶水解条件Table 1. Hydrolysis conditions of different proteases酶种类 酶解温度(℃) pH 复合蛋白酶 50 7.0 风味蛋白酶 45 5.8 中性蛋白酶 45 7.0 碱性蛋白酶 50 10.0 木瓜蛋白酶 60 6.0 1.2.4.2 酶解温度的影响
称取200 g蛤蜊肉5份,分别匀浆,按料液比1:2加纯水混匀。温度设定为45、50、55、60、65 ℃,调节pH7.0,选择复合蛋白酶,加酶量1000 U/g原料肉,酶解时间为4 h。其余步骤按“1.2.2”操作。取酶解液测水解度。
1.2.4.3 初始pH的影响
称取200 g蛤蜊肉5份,匀浆。初始pH分别为5.0、6.0、7.0、8.0、9.0,温度为单因素实验中最适值,其他酶解条件同“1.2.4.2”。取酶解液测水解度。
1.2.4.4 料液比的影响
称取200 g蛤蜊肉5份,匀浆,依次按料液比1:1、1:1.5、1:2、1:2.5、1:3加纯水搅匀,温度和pH为单因素实验中最适值,其他酶解条件同“1.2.4.2”。取酶解液测水解度。
1.2.4.5 加酶量的确定
称取200 g蛤蜊肉5份,匀浆。加酶量分别为600、800、1000、1200、1400 U/g原料肉,酶解温度、pH和料液比为单因素实验中最适值,其他酶解条件同“1.2.4.2”。取酶解液测水解度。
1.2.4.6 酶解时间的影响
称取200 g蛤蜊肉5份,匀浆。酶解时间设定为2、4、6、8、10 h,酶解温度、pH、料液比和加酶量为单因素实验中最适值,其他酶解条件同“1.2.4.2”。酶解结束后测定酶解液水解度。
1.2.5 红岛蛤蜊肉酶解正交试验
在单因素酶解实验的基础上,选择对酶解结果影响较关键的温度、时间、料液比三因素,以水解度为指标,进行L9(34)正交试验进行酶解工艺的优化,试验因素与水平见表2。
表 2 正交试验设计因素水平表Table 2. Factors and levels of orthogonal test水平 因素 A酶解温度(℃) B酶解时间(h) C料液比 1 52 3 1:2.5 2 55 4.5 1:2 3 58 6 1:1.5 1.2.6 水解度的测定和计算
水解度的测定参见文献[14]中的方法,水解度的计算公式为:
式中:A:原料中总氮含量,g/100 g; B:水解液中氨基氮含量,g/100 g;C:原料游离的氨基氮含量,g/100 g;D:原料中非蛋白氮含量,g/100 g。
1.2.7 蛤蜊肽分子量分布的检测
1.2.7.1 酶解蛤蜊肽样品的制备
按优化后的工艺条件制备的酶解液,经灭酶、真空抽滤分别通过0.8、0.45 μm的微滤膜,然后经冷冻干燥制得蛤蜊肽粉,用于分子量分布及降血压功能分析。
1.2.7.2 分子量分布的检测
采用高效液相色谱法[14,17]测定蛤蜊肽分子量分布情况。测定条件:色谱柱为TSKgel G2000 SWXL(7.8 mm×300 mm)凝胶柱;流动相为乙腈:水:三氟乙酸=45:55:0.1(体积比);紫外检测器的波长设为220 nm;泵流速设为0.5 mL/min;柱温设为30 ℃;进样体积为10 μL。肽标准品:细胞色素C(Mw 12355)、抑肽酶(Mw 6511)、杆菌酶(Mw 1422)、乙氨酸-乙氨酸-酪氨酸-精氨酸(Mw 451)、乙氨酸-乙氨酸-乙氨酸(Mw 189),将各多肽标准品用流动相配制成1.0 g/L的溶液,经0.22 μm聚四氟乙烯膜过滤后进样,以各标准品相对分子量对保留时间作图,得到标准曲线和线性回归方程。将蛤蜊肽粉配制成5 mg/mL的样品,相同条件下进行色谱分析,利用GPC数据分析计算分子量分布。
1.2.8 体外ACE抑制率的检测
将蛤蜊肽按Cushman等[18]改进的方法制备反应液,一定量的蛤蜊肽粉溶解在5 mmol/L的硼酸缓冲液(pH8.3,0.3 mol/L NaCl)中,取20 μL样品加入50 μL 2.5 mmol/L马尿酸-组氨酰-亮氨酸(Hip-His-Leu, HHL),混匀,37 ℃预热6 min,加入10 μL 0.1 U ACE,37 ℃反应30 min,加入100 μL 1 mol/L HCl终止反应。空白对照采用5 mmol/L硼酸缓冲液代替样品。
采用高效液相色谱法测定蛤蜊肽ACE抑制率[19],色谱条件如下:InertSustain AQ-C18色谱柱(4.6 mm×150 mm),流动相:A,含0.1%三氟乙酸的纯水;B,乙腈。按如下梯度洗脱:0~10 min,5%~60%B;10~12 min,60%B;12~13 min,60%~5%B;13~17 min,5%B。抑制率计算公式为:
式中:R:酶解样品对ACE的抑制率,%;A:空白对照组中马尿酸的峰面积;B:添加蛤蜊肽粉样品组中马尿酸的峰面积;IC50值:当ACE抑制率为50%时的肽粉溶液浓度,mg/mL。
1.3 数据处理
每次实验设3组平行,数据采用
2. 结果与分析
2.1 红岛蛤蜊肉营养成分
红岛蛤蜊是一类营养丰富,味道鲜美的海洋贝类,为更好地了解和利用蛤蜊中的营养成分,对其组成成分进行分析,见表3。红岛蛤蜊除水分外的主要成分是蛋白质,含量17.68% ± 0.38%,换算干基重为68.81% ± 1.46%,高于一般陆地动物肉的蛋白含量[20],在常见贝类中也属于较高的水平[21]。蛤蜊肉脂肪含量低于普通肉类食品,是低脂食品的优选。蛤蜊肉总糖中含有较高的低分子量寡糖和低聚糖,这可能是红岛蛤蜊风味偏甜顺口的主要原因。灰分占比较高,换算干基重为6.67% ± 0.02%,高于一般肉类产品,说明红岛蛤蜊中含丰富的无机矿物质。综上而言,红岛蛤蜊是一种高蛋白、低脂肪的高营养健康食品。
表 3 红岛蛤蜊营养成分表Table 3. Nutrients in Hongdao clam营养成分 水分 粗蛋白 粗脂肪 总糖 灰分 含量(%) 74.30 ± 0.72 17.68 ± 0.38 1.35 ± 0.05 1.28 ± 0.04 1.71 ± 0.01 2.2 蛋白酶制剂的筛选
蛋白酶是可以水解蛋白质肽键的一类酶的总称,不同蛋白酶对蛤蜊肉蛋白的水解位点不同,水解度也会有差异。本研究选取了酶解水产品常用的5种蛋白酶:复合蛋白酶、中性蛋白酶、风味蛋白酶、碱性蛋白酶、木瓜蛋白酶,以水解度为指标,酶解结果如图1所示。复合蛋白酶对蛤蜊肉的水解度最高,为50.29% ± 0.21%,因此选择复合蛋白酶进行酶解实验。
2.3 单因素实验结果
2.3.1 酶解温度的影响
酶解温度对水解度影响如图2所示。当温度在45~55 ℃时,随温度升高,酶活增大,水解度持续增加,55 ℃时水解度达到最大值66.52% ± 0.65%。当温度继续升高,水解度下降,这主要是因为酶解温度过高,导致部分蛋白酶的结构遭到破坏、变性,酶活降低。因此复合蛋白酶酶解红岛蛤蜊肉的适宜温度为55 ℃。
2.3.2 初始pH的影响
酶解初始pH对水解度的影响如图3所示。随pH的升高,酶解液的水解度首先呈迅速升高趋势,pH7.0时,水解度为65.40% ± 0.21%。当pH大于8.0时水解度显著下降(P<0.05),可能是碱性环境破坏了酶的空间结构,造成酶活降低。在复合蛋白酶可耐受pH7.0~8.0的范围内,水解度无显著性差异(P>0.05),且pH=7.0最接近原料肉的自然pH,同时中性环境对生产设备损害较小,故选择酶解体系最适pH为7.0,正交试验中不再对这一因素进行优化。
2.3.3 料液比的影响
料液比对蛤蜊肉酶解产物水解度的影响如图4所示。结果表明,酶解液水解度随料液比增大呈现先上升后下降的趋势,当料液比为1:2.5时,水解度达到最大值为66.46%±0.57%,但与料液比为1:2时无显著性差异(P>0.05)。当料液比较小时,酶解体系较黏稠,流动性差,阻碍蛋白酶分子与酶解底物的扩散[22],使酶与底物无法充分结合。随料液比增大,复合蛋白酶分子充分参与到酶解反应中,料液比处于1:1.5~1:2.5之间,水解度趋于平缓。料液比继续增大到1:3时,水解度下降,推测是体系中底物浓度降低,酶与底物接触不充分[23],不利于酶解。因此选择水解度最高的料液比1:2。
2.3.4 加酶量的确定
红岛蛤蜊肉酶解液的水解度随复合蛋白酶用量的增加变化趋势如图5所示。结果显示在选择的加酶量范围内,水解度随加酶量的增多而增大,加酶量为1000 U/g时,水解度为66.27%±0.28%,之后继续增加酶量,水解度趋于平稳。酶解开始时,增加酶用量会增加酶与底物的接触率,促进水解反应,当酶量增加到一定程度,过多的酶解产物可能对酶解反应产生反馈抑制作用[24]。合理的酶添加量不仅可以达到满意的酶解效果,同时避免酶的浪费。由以上分析可知,加酶量为1000 U/g时,加酶量趋于饱和,因此,加酶量选择1000 U/g,在正交试验中不再对此因素进行优化。
2.3.5 酶解时间的影响
酶解时间对红岛蛤蜊肉酶解效果的影响如图6所示。酶解初始阶段2~4 h,水解度迅速增加,4 h已达水解度66.13% ± 0.70%,时间继续延长,水解度变化趋缓。因为反应刚开始时,酶和底物浓度均较高,酶解速度较快,随反应进行,酶解产物逐渐积累,一方面是游离肽的增多导致产物的抑制作用增强,另一方面可能是因为酶解体系的pH发生变化使酶活降低。综合考虑,选择酶解时间为4 h左右。
2.4 正交试验优化酶解工艺
2.4.1 酶解工艺参数优化正交试验结果
复合蛋白酶水解红岛蛤蜊肉的正交试验结果及方差分析见表4、表5。由直观分析结果可以看出,对水解度影响的大小顺序为:B(酶解时间)>C(料液比)>A(酶解温度)。复合蛋白酶酶解红岛蛤蜊肉的最佳工艺参数为:A3B3C2。方差分析显示,酶解时间对水解度有显著影响,酶解温度与料液比影响均不显著。故以直观分析结果作为最佳优化条件,即:酶解温度58 ℃、酶解时间6 h、料液比1:2,在此条件下,水解度为71.58%。
表 4 正交试验设计及结果Table 4. Design and results of orthogonal test试验号 因素 水解度(%) A B C 1 1 1 1 60.81 ± 0.84 2 1 2 2 66.01 ± 0.36 3 1 3 3 65.10 ± 0.54 4 2 1 2 63.11 ± 0.62 5 2 2 3 63.89 ± 0.60 6 2 3 1 68.98 ± 0.34 7 3 1 3 62.46 ± 0.63 8 3 2 1 65.24 ± 0.28 9 3 3 2 71.58 ± 0.50 k1 63.97 62.13 65.01 k2 65.33 65.05 66.90 k3 66.43 68.55 63.82 R 2.45 6.43 3.08 表 5 正交实验方差分析Table 5. Analysis of variance of orthogonal test方差来源 偏差平方和 自由度 F值 F临界值 显著性 A 9.060 2 3.213 19.000 B 62.125 2 22.030 19.000 * C 14.503 2 5.143 19.000 误差 2.82 2 注:*表示差异显著,P<0.05。 2.4.2 最优组合条件验证
称取200 g红岛蛤蜊肉,匀浆后调节pH7.0,按料液比1:2加入纯水,加酶量1000 U/g,于58 ℃下水解6 h后,制备酶解液。重复验证三次,测得蛤蜊肉的水解度为71.03%±0.69%,高于正交试验中其他组合,表明优化条件稳定可信。
2.5 蛤蜊肽分子量分布
为研究蛤蜊肽降血压活性,首先对蛤蜊肽进行分子量分布的研究,分子量分布如图7与表6所示。结合分子质量标准曲线,利用GPC数据处理软件计算得出:多肽Mr≤1000 Da所占比例94.29%;1000<Mr≤3000所占比例5.41%;Mr>3000所占比0.16%。结果表明在优化的工艺条件下,复合蛋白酶对红岛蛤蜊肉酶解较充分,多数蛋白大分子已被酶解为1000 Da以下的寡肽,又称小分子活性肽,易被肠道吸收利用。有关生物肽的研究显示[11-12],具生物活性的多肽分子质量大部分在3000 Da以下或1000 Da以下。
表 6 蛤蜊肽相对分子质量分布Table 6. The molecular weight distribution of calm peptide色谱峰序号 保留时间(min) 峰面积 相对分子质量(Da) 比重(%) 1 16.532 5545633 1438 15.06 2 17.477 10570338 620 28.70 3 19.066 11681280 273 31.72 4 19.688 7977525 159 21.66 2.6 蛤蜊肽降血压活性
蛤蜊肽的降血压活性是通过测定体外ACE抑制率来实现的。ACE抑制肽是通过抑制ACE酶活性,来阻碍血管紧张素Ⅱ的生成以及抑制血管缓激肽的分解以达到降血压的作用[25-27]。红岛蛤蜊肽对ACE抑制结果如图8所示。ACE抑制率随肽粉浓度的增加而增大,最后逐渐趋于稳定,经ELISA数据拟合并计算其IC50值为0.67 mg/mL。这表明复合蛋白酶酶解制得的红岛蛤蜊肽具有较高的ACE抑制活性。相关研究表明,食源性降压肽主要由2~12个氨基酸组成[28],具有安全性高、分子量小、易被吸收的特点[29],因此蛤蜊肽的ACE抑制活性可能与小分子多肽有很大关系,尤其是Mr<1000 Da的寡肽在ACE活性抑制中可能起到关键作用。
3. 结论
红岛蛤蜊鲜肉营养丰富,是一类高蛋白低脂肪优质水产品。在筛选的5种蛋白酶中,复合蛋白酶酶解的红岛蛤蜊肉酶解效果最好。通过单因素实验和正交试验设计,最终优化的酶解工艺参数为:酶解温度58 ℃、酶解时间6 h、pH为7.0、料液比1:2、加酶量1000 U/g,在此工艺条件下,水解度可达71.03%。将最优酶解工艺条件下的蛤蜊肽进行分子量分布和降血压功能分析表明,多肽中分子量低于1000 Da的占比高达94.29%,且蛤蜊肽显示出良好的ACE抑制率,其IC50值为0.67 mg/mL。蛤蜊肽的降血压活性可能与分子量小于1000 Da的肽段有关,具体作用机制有待进一步研究。作为海洋来源的ACE抑制肽,蛤蜊肽有作为健康食品和功能食品生物活性原料的潜能,具有广阔的开发和应用空间。
-
表 1 不同蛋白酶水解条件
Table 1 Hydrolysis conditions of different proteases
酶种类 酶解温度(℃) pH 复合蛋白酶 50 7.0 风味蛋白酶 45 5.8 中性蛋白酶 45 7.0 碱性蛋白酶 50 10.0 木瓜蛋白酶 60 6.0 表 2 正交试验设计因素水平表
Table 2 Factors and levels of orthogonal test
水平 因素 A酶解温度(℃) B酶解时间(h) C料液比 1 52 3 1:2.5 2 55 4.5 1:2 3 58 6 1:1.5 表 3 红岛蛤蜊营养成分表
Table 3 Nutrients in Hongdao clam
营养成分 水分 粗蛋白 粗脂肪 总糖 灰分 含量(%) 74.30 ± 0.72 17.68 ± 0.38 1.35 ± 0.05 1.28 ± 0.04 1.71 ± 0.01 表 4 正交试验设计及结果
Table 4 Design and results of orthogonal test
试验号 因素 水解度(%) A B C 1 1 1 1 60.81 ± 0.84 2 1 2 2 66.01 ± 0.36 3 1 3 3 65.10 ± 0.54 4 2 1 2 63.11 ± 0.62 5 2 2 3 63.89 ± 0.60 6 2 3 1 68.98 ± 0.34 7 3 1 3 62.46 ± 0.63 8 3 2 1 65.24 ± 0.28 9 3 3 2 71.58 ± 0.50 k1 63.97 62.13 65.01 k2 65.33 65.05 66.90 k3 66.43 68.55 63.82 R 2.45 6.43 3.08 表 5 正交实验方差分析
Table 5 Analysis of variance of orthogonal test
方差来源 偏差平方和 自由度 F值 F临界值 显著性 A 9.060 2 3.213 19.000 B 62.125 2 22.030 19.000 * C 14.503 2 5.143 19.000 误差 2.82 2 注:*表示差异显著,P<0.05。 表 6 蛤蜊肽相对分子质量分布
Table 6 The molecular weight distribution of calm peptide
色谱峰序号 保留时间(min) 峰面积 相对分子质量(Da) 比重(%) 1 16.532 5545633 1438 15.06 2 17.477 10570338 620 28.70 3 19.066 11681280 273 31.72 4 19.688 7977525 159 21.66 -
[1] 孙晓东, 谭书明. 木瓜蛋白酶酶解制备红岛蛤蜊肉多肽工艺的研究[J]. 贵州农业科学,2017,45(2):146−149. doi: 10.3969/j.issn.1001-3601.2017.02.035 [2] 栾和密, 吴皓, 方东, 等. 蛤蜊化学成分及其生物活性物质研究进展[J]. 中国海洋药物,2008,6(1):23−26. [3] 张士军. 基于产业链视角的红岛蛤蜊产业分析[J]. 中国渔业经济,2014,32(1):115−116. doi: 10.3969/j.issn.1009-590X.2014.01.019 [4] 冯金晓, 袁昊. 中性蛋白酶酶解红岛蛤蜊工艺研究[J]. 现代食品,2019(22):88−94. [5] 石亚萍, 张锦松, 贾爱荣, 等. 蛤蜊酶解条件的优化及其酶解物抗疲劳活性的研究[J]. 食品工业,2017,38(2):155−159. [6] Krishnamoorthy E, Bangalore A S. Angiotensin I-converting enzyme inhibitory activity of protein hydrolysates prepared from three freshwater carps(Catla catla, Labeo rohita and Cirrhinus mrigala) using flavorzyme[J]. International Journal of Food Science & Technology,2014,49:1344−1350.
[7] Wang Q K, Li W, He Y H, et al. A novel antioxidant and ACE inhibitory peptide from rice bran protein: Biochemical characterization and molecular docking study[J]. LWT-Food Science and Technology,2017,75:93−99. doi: 10.1016/j.lwt.2016.08.047
[8] 詹秋桂, 李洁煌, 施鹏飞, 等. 响应面法优化青蛤降血压肽酶解制备工艺[J]. 安徽农业科学,2018,46(5):7−9, 24. doi: 10.3969/j.issn.0517-6611.2018.05.003 [9] Zhou Y J, He Q, Zhou D. Optimization extraction of protein from mussel by high-intensity pulsed electric fields[J]. Journal of Food Processing and Preservation,2016,7:1−8.
[10] Xue Li, Luo Y K, You J, et al. In vitro antioxidant activity of papain-treated grass carp (Ctenopharyngodon idellus) protein hydrolysate and the preventive effect on fish mince system[J]. International Journal of Food & Technology,2012,47(5):961−967.
[11] Liu X, Zhang M, Shi Y, et al. Production of the angiotensin Ⅰconverting enzyme inhibitory peptides and isolation of four novel peptides from jellyfish (Rhopilema esculentum) protein hydrolysate[J]. Journal of the Science of Food and Agriculture,2016,96(9):3240−3248. doi: 10.1002/jsfa.7507
[12] 朱俊向, 于丁一, 宋玉凤, 等. 动物蛋白水解酶法制备南极磷虾多肽及其抗氧化活性[J]. 中国调味品,2019,44(4):104−107. doi: 10.3969/j.issn.1000-9973.2019.04.022 [13] 陈启航, 朱秀花, 俞珺, 等. 金枪鱼蒸煮液酶解工艺优化及风味海鲜调味汁的制备[J]. 食品工业科技,2018,39(9):124−130. [14] 曹文红, 章超桦, 秦小明, 等. 牡蛎肉酶解工艺优化及其产物的分子质量分布研究[J]. 食品科技,2019,44(7):185−190. [15] 王永华, 戚穗坚. 食品分析[M]. 第3版. 北京: 中国轻工业出版社, 2017: 201-350. [16] 中国国家标准化管理委员会. GB/T 9695.31-2008 肉制品 总糖含量的测定[S]. 北京: 中国标准出版社, 2008. [17] 张杰, 丁琳, 白鸽, 等. 超声对木瓜蛋白酶酶解产物分子量分布的影响[J]. 食品工业科技,2017,38(14):116−120. [18] Cushman D W, Cheung H. Spectrophotometric assay and properties of the angiotensin converting enzyme of rabbit lung[J]. Biochem Pharmol,1971,20:911−917.
[19] Zhang Yan, Chang S K C. Comparative studies on ACE inhibition, degree of hydrolysis, antioxidant property and phenolic acid composition of hydrolysates derived from simulated in vitro gastrointestinal proteolysis of three thermally treated legumes[J]. Food Chemistry,2019,281:154−162. doi: 10.1016/j.foodchem.2018.12.090
[20] 杨月欣. 中国食物成分表[M]. 第6版.第二册, 北京: 北京大学医学出版社, 2018: 51−80. [21] 雷晓凌, 吴晓萍, 张海花, 等. 南海八种贝类营养成分和限量元素含量的研究[J]. 中国海洋药物,2001(2):48−50. doi: 10.3969/j.issn.1002-3461.2001.02.014 [22] 吕乐, 丁慧璞, 胡伟, 等. 金枪鱼粉的酶解工艺及其酶解产物功能活性研究[J]. 食品工业科技,2020,41(3):168−174. [23] Saidi S, Belleville M P, Deratani A, et al. Production of interesting peptide fractions by enzymatic hydrolysis of tuna dark muscle by-product using alcalase[J]. Journal of Aquatic Food Product Technology,2016,25(2):251−264. doi: 10.1080/10498850.2013.844753
[24] 吕小京, 操德群, 徐年军. 响应面试验优化酶解法制备海洋微藻微拟球藻抗氧化肽工艺[J]. 食品科学,2018,39(6):183−188. doi: 10.7506/spkx1002-6630-201806029 [25] Ichimura T, Hu J, Aita D Q, et al. Angiotensin I-converting enzyme inhibitory activity and insulin secretion stimulative activity of fermented fish sauce[J]. Journal of Bioscience & Bioengineering,2003(5):496−504.
[26] 邱娟, 沈建东, 翁凌, 等. 利用牡蛎制备ACE抑制肽的工艺优化[J]. 食品科学,2017,38(16):165−172. doi: 10.7506/spkx1002-6630-201716026 [27] Tao M, Sun H, L iu L, et al. Graphitized porous carbon for rapid screening of angiotensin-converting enzyme in hibitory peptide GAMVVH from Silkworm pupa protein and molecular insight into inhibition mechanism[J]. Journal of Agricultural and Food Chemistry,2017,65(39):8626−8633. doi: 10.1021/acs.jafc.7b03195
[28] 胡昂, 段蕊, 刘志东, 等. 贝类生物活性肽的研究进展[J]. 渔业信息与战略,2019,34(2):128−134. [29] 李谋, 杨小琳, 赵金礼. 食源性血管紧张素转换酶抑制肽的研究进展[J]. 医学综述,2019,25(8):1490−1494. doi: 10.3969/j.issn.1006-2084.2019.08.007





 下载:
下载:

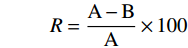
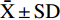








 下载:
下载:
